
| A. | 利用潮汐能电解水制氢气 | B. | 大力推广乙醇汽油燃料汽车 | ||
| C. | 利用甲烷制造燃料电池 | D. | 提倡化石燃料燃烧 |
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
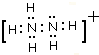 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙醇与水反应 | |
| B. | 氧化钙与水反应 | |
| C. | 甲烷在氧气中燃烧 | |
| D. | 氢氧化钡晶体[Ba(OH)2•8H2O]与氯化铵晶体混合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com