
| A、向某溶液中加入稀盐酸,产生能使石灰水变浑浊的气体,该溶液一定含有CO32- |
| B、向某溶液中滴加氯水后,滴加KSCN溶液,溶液呈红色,该溶液中一定含有Fe2+ |
| C、向某溶液中加入氯化钡溶液,产生不溶于稀盐酸白色沉淀,该溶液一定含有SO42- |
| D、往某溶液中加入NaOH,微热,产生能使湿润的红色石蕊试纸变蓝的气体,该溶液中一定含有NH4+ |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成物的总能量总是低于反应物的总能量 |
| B、应用盖斯定律,可计算某些难以直接测量的反应热 |
| C、化学反应中的能量变化都表现为热量变化 |
| D、需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| ①取少量原溶液,加入稀盐酸, | 产生无色气体,该气体能使澄清的石灰水变浑浊 |
| ②取少量原溶液加热浓缩,加入Cu片和一定浓度的H2SO4 | 有无色气体产生,该气体遇空气变成红棕色 |
| ③取少量原溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,先加入稀硝酸,再加入AgNO3溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
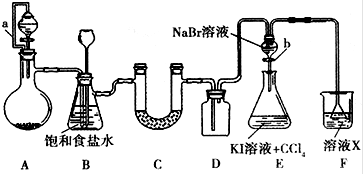
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 氯化钙 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
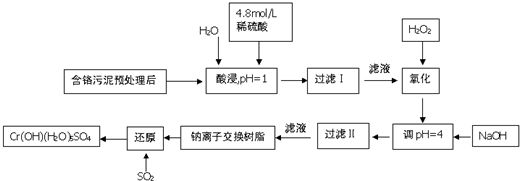
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.
A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com