
| A. | 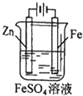 铁片镀锌 | B. | 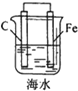 模拟吸氧腐蚀 | C. | 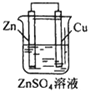 铜锌原电池 | D. | 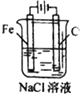 电解法制氯气 |
分析 A.电镀时,镀层金属为阳极,镀件金属为阴极,电解质溶液应含有镀层金属;
B.当电解质溶液呈中性、碱性时,发生吸氧腐蚀;
C.不能进行自发的氧化还原反应;
D.不能用铁作阳极,应用惰性电极.
解答 解:A.电镀时,电解质溶液应为硫酸锌,故A错误;
B.当电解质溶液呈中性、碱性时,发生吸氧腐蚀,题中装置为吸氧腐蚀,故B正确;
C.硫酸锌和锌不反应,不能进行自发的氧化还原反应,应用硫酸铜或硫酸溶液,故C错误;
D.用铁作阳极,阳极上铁被氧化,不能在阳极上生成氯气,应用惰性电极,故D错误.
故选B.
点评 本题综合考查原电池和电解池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电镀、金属的腐蚀以及原电池、电解池的工作原理,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:
神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g 5.00% 的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.99%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g 5.00% 的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.99%,乙中c电极质量增加,据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
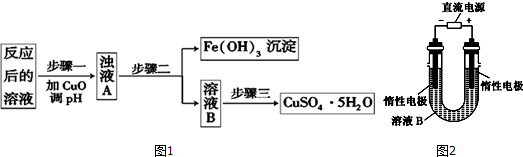
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
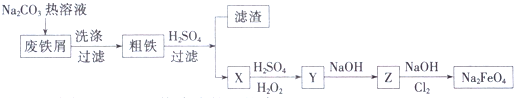
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题:
A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
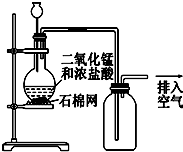
| A. | 该装置图中至少存在三处明显错误 | |
| B. | 该实验中收集氯气的方法不正确 | |
| C. | 如果需要得到干燥纯净的Cl2,只需在气体发生装置和收集装置之间连接一个装有浓硫酸的洗气瓶即可 | |
| D. | 含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
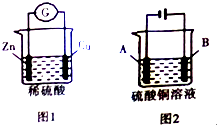
| A. | 图1装置将化学能转化为电能,电子由锌极经过稀硫酸进入铜极 | |
| B. | 利用图2装置可进行粗铜的精炼,则粗铜做A极 | |
| C. | 若A、B两电极均为铜,利用图2装置电解硫酸铜溶液,则电解后溶液的pH不变 | |
| D. | 利用图2装置可在铁上镀铜,则铁作B极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com