
下列有关原电池的叙述中不正确的是
A. 原电池是将化学能转化为电能的装置
B. 在原电池中,电子流出的一极是负极,发生氧化反应
C. 锌、铜、硫酸组成的原电池中,溶液中的 Zn2+、 H+均向正极移动
D. 构成原电池的两个电极必须是活泼性不同的两种金属
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源:2016-2017学年江西省高一3月月考化学试卷(解析版) 题型:选择题
元素X~Z是元素周期表中4种主族元素,其性质或结构信息如下表,有关下列元素的描述错误的是( )
元素 | X | Y | W | Z |
相关信息 | 用硫酸处理海藻灰时,可得通常状况下为紫黑色的固体,其制剂可用来消毒. | 工业上在冰晶石存在的条件下,用电解法制取其单质. | 最早是在用氯气处理提取食盐后的盐水母液中发现的,被称作“海洋元素”. | 原子的电子总数是最外层电子数的6倍 |
A. 实验室可在海藻灰的浸出液中滴加双氧水来制取元素X的单质
B. 元素X、Y的单质充分混合后滴加少量水,可看到大量紫色蒸汽生成,说明该反应会放出大量的热
C. 元素X的气态氢化物的沸点高于元素W的气态氢化物的沸点
D. 元素Z是一种较活泼的金属元素,可用铝热法从Z的氧化物中制备Z的单质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一下学期第一次月考化学试卷(解析版) 题型:选择题
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下气体0.224 L.则下列判断中正确的是
A.原混合物中n(Fe)∶n(Fe2O3)=2∶1
B.向溶液中滴入KSCN溶液,显红色
C.无法计算原混合物的质量a
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省益阳市高一下学期3月月考化学试卷(解析版) 题型:填空题
目前,市场上有多种“热敷袋”出售。某一化学研究性学习小组在研究了某种“热敷袋”的构造后,决定自己制造一个一次性“热敷袋”,制造过程如下:①称取15g小颗粒状活性炭,40g还原铁粉,5g细木屑,都放在一只烧杯中,再加入15mL 15%食盐水,用玻璃棒搅拌均匀。②用大头针在小塑料袋上扎几十个针眼 (袋的两层同时扎穿),把烧杯里的混合物全部加入小塑料袋中,封上袋口,再放入大塑料袋中,封上袋口,可长期保存。③使用时将大塑料袋袋口打开,反复搓揉这袋5min~8min,能感觉温度明显上升。回答下列问题:
(1)该一次性“热敷袋”利用了_____________原理。
(2)炭粉的作用是________________。
(3)将使用过的“热敷袋”打开,发现有大量棕红色粉末生成,该物质主要成分是__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省益阳市高一下学期3月月考化学试卷(解析版) 题型:选择题
应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①Be的氧化物的水化物可能具有两性
②第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体 ⑥H2Se是无色、有毒、比H2S稳定的气体
A. ①②③④ B. ②④⑥ C. ①③⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省益阳市高一下学期3月月考化学试卷(解析版) 题型:选择题
原子结构决定元素的性质,下列说法中,正确的是
A. Na、Al、Cl的原子半径依次减小,Na+、Al3+、C1-的离子半径也依次减小
B. 在第VIA族元素的氢化物(H2R)中,热稳定性最强的其沸点也最高
C. 第2周期元素的最高正化合价都等于其原子的最外层电子数
D. 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
查看答案和解析>>
科目:高中化学 来源:2017届宁夏银川市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:实验题
水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
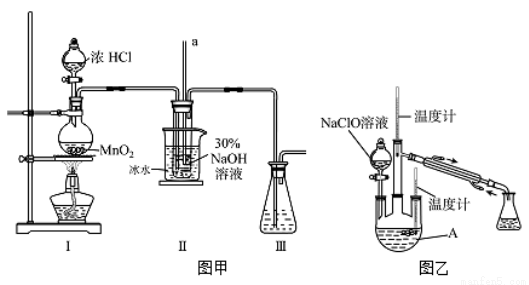
已知:3NaClO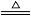 2NaCl+NaClO3
2NaCl+NaClO3
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品,B装置的名称是______________
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一下学期3月月考化学试卷(解析版) 题型:选择题
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是( )
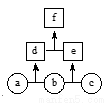
A. 常温下,单质a呈气态 B. 单质c具有强氧化性
C. 稳定性:d>e D. f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
上图为元素周期表截取的短周期的一部分,即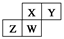 。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是
。四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是
A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:Z>W>X>Y
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com