
 转变为
转变为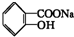 的方法是( )
的方法是( )| A. | 与足量NaOH溶液共热后,再加盐酸 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量NaHCO3溶液 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
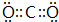 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$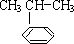 ,反应类型为加成反应
,反应类型为加成反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| N(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示,是原电池的装置图.请回答:
如图所示,是原电池的装置图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
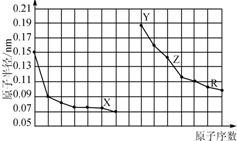
| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com