
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的 ①NH4Cl溶液②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2CO3溶液中NH4+浓度的大小关系是 ②>④>①>③ |
分析 A.0.1 mol/L Na2CO3溶液中存在质子守恒,水电离出的氢氧根离子总数等于水电离出氢离子总数;
B.0.1 mol/L NH4Cl溶液中氯化铵是强酸弱碱盐,铵根离子水解溶液显酸性;
C.结合溶液中电荷守恒分析判断;
D.物质的量相等的这几种溶液中,铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可.
解答 解:A.0.1 mol/L Na2CO3溶液中存在质子守恒,c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故A正确;
B.溶液中铵根离子水解溶液显酸性,溶液中离子浓度大小c(Cl-)>c(NH4+ )>c(H+)>c(OH-),故B错误;
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中 存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),得到的酸性混合溶液,c(H+)>c(OH-),c(Na+)<c(CH3COO-),故C错误;
D.①③中铵根离子系数都是1,氢离子抑制铵根离子水解,溶液中铵根离子浓度③>①;②④中铵根离子系数都是2,②④铵根离子浓度大于①②,碳酸根离子促进铵根离子水解,溶液中铵根离子浓度②>④,则溶液中铵根离子浓度从小到大顺序是②>④>③>①,故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒、物料守恒的分析判断,主要是盐类水解影响因素的理解应用,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 物质的量 | B. | 相对原子质量 | ||
| C. | 物质的摩尔质量 | D. | 12g12C中所含有的C原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素形成的单核阴离子还原性强于X | |
| B. | Z元素的简单气态氢化物的沸点比Y高 | |
| C. | W元素氧化物对应的水化物的酸性一定强于Z | |
| D. | X的气态氢化物可与其最高价含氧酸反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在任何条件都能自发进行 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
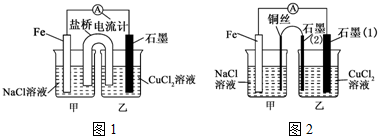
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I- | |
| B. | 能与金属铝反应放出H2的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20mol/L的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①④ | C. | ③⑥ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者是混合物,后者是纯净物 | |
| B. | 两者都具有丁达尔效应 | |
| C. | 分散质的粒子直径均在1~100nm之间 | |
| D. | 前者可用于杀菌,后者可用于净水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com