
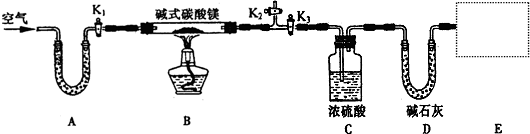
(8分)某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物a g,溶于200 ml 5 mol/L HCl溶液中,共收集到标准状况下的氢气3.36 L。
(1)a的取值范围是__________________。
(2)向反应后所得溶液中逐渐加入4 mol/L的NaOH溶液。当沉淀质量达到最大值时,加入的NaOH溶液的体积是多少毫升?沉淀的最大质量为多少克?(用含a的代数式表示)。
(3)继续加入NaOH溶液至沉淀质量不再发生变化时,过滤、洗涤并灼烧沉淀至恒重,所得残余固体的质量仍为a g,计算原混合物中铝的质量分数。
(8分)(1)2.7<a<3.6 (2)250 ,a+5.1 (3)40%
解析试题分析:(1)标准状况下3.36L气体的物质的量是3.36L÷22.4L/mol=0.15mol。根据反应的方程式2Al+6H+=2Al3++3H2↑、Mg+2H+=Mg2++H2↑可知,如果全部是铝生成的氢气,则铝的质量是0.1mol×27g/mol=2.7g。如果全部是镁生成的,则镁的质量是0.15mol×24g.mol=3.6g,所以a的取值范围是2.7<a<3.6。
(2)当沉淀质量达到最大值时,溶液中的溶质恰好是氯化钠,所以根据原子守恒可知,需要氢氧化钠的物质的量是0.2L×5mol/L=1mol,则需要氢氧化钠溶液的体积是1mol÷4mol/L=0.25L=250ml。镁或铝失去多少电子,相应的计算阳离子就结合多少OH-生成相应的氢氧化物沉淀。氢气是0.15mol,转移0.3mol电子。所以和金属阳离子结合的OH-的物质的量就是0.3mol,则沉淀的质量就是ag+0.3mol×17g/mol=(a+5.1)g。
(3)根据实验现象可知,过滤得到的白色沉淀是氢氧化镁,灼烧则生成氧化镁,这说明氧化镁的质量和原混合物的质量相等。由于镁原子的质量没有改变,因此原混合物中铝的质量分数就是氧化镁中氧元素的质量分数,即为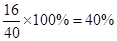 。
。
考点:考查镁、铝溶于酸的有关计算
点评:该题的反应过程比较复杂,有关的化学方程式也比较多。该题的解题思路仍然是抛弃反应过程,根据最终的结果,充分利用各种解题技巧,抓住问题的关键,化繁为简。该题的难度较大,对学生的思维要求较高。既考查了学生的对基础知识的熟练程度,更重要的是考查学生灵活运用知识解决实际问题的解题能力。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
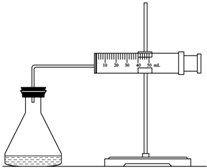 实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应.| 实验编号 试剂 |
A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省5月高考三轮模拟化学试卷(解析版) 题型:填空题
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。

(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10—1mol) |
4.3 |
5.9 |
6.0 |
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq)
+2NH3·H2O(aq)
Mg2+(aq)
+2NH3·H2O(aq)
写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
|
实验① |
等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 |
生成白色沉淀 |
|
实验② |
等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 |
无现象 |
请分析实验①、②产生不同现象的原因: 。
(5)在室温下,化学反应I—(aq)+ ClO—(aq) = IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
|
实验编号 |
I—的初始浓度 (mol·L—1) |
ClO—的初始浓度 (mol·L—1) |
OH—的初始浓度 (mol·L—1) |
初始速率v (mol·L—1· s—1) |
|
1 |
2 × 10—3 |
1.5 × 10—3 |
1.00 |
1.8 × 10—4 |
|
2 |
a |
1.5 × 10—3 |
1.00 |
3.6 × 10—4 |
|
3 |
2 × 10—3 |
3 × 10—3 |
2.00 |
1.8 × 10—4 |
|
4 |
4 × 10—3 |
3 × 10—3 |
1.00 |
7.2 × 10—4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com