
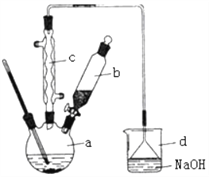
����Ŀ�������屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�
�� | �� | �屽 | |
�ܶ�/g��cm-3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
�����²���ش����⣺
��1����a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mL Һ̬�塣��a�е��뼸���壬a��Һ���������ڣ����к���ɫ�������֣�a�з����Ļ�ѧ����ʽΪ_______________________�������μ���Һ����ꡣ����a��������___________װ��d�е�������_______________________������cΪ�����ܣ����ˮ��Ϊ__________________������������������������
��2��Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10 mLˮ��8 mL10����NaOH��Һ��10 mLˮϴ�ӡ�NaOH��Һϴ�ӵ�������_______________________��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ����_______________________��
��3��������������������屽�л����е���Ҫ����Ϊ____��Ҫ��һ���ᴿ�����в����б������____��
A���ؽᾧ B������ C������ D����ȡ
���𰸡� 2Fe+3Br2=2FeBr3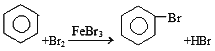 ������ƿ ����HBr���� �� ��ȥHBr��δ��Ӧ��Br2 �������е�ˮ�� �� C
������ƿ ����HBr���� �� ��ȥHBr��δ��Ӧ��Br2 �������е�ˮ�� �� C
����������1�������巴Ӧ�������廯�������廯���뱽���ã������屽��ͬʱ���廯�����ɣ�a�з����Ļ�ѧ����ʽΪ��2Fe+3Br2=2FeBr3��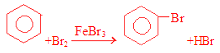 ������a��������������ƿ��������������������������Ʒ�Ӧ����������ˮ���廯�ƺ�ˮ���嵥�ʺ��������Ʒ�Ӧ������������ˮ���廯�ƺʹ������ƣ�װ��d�е�����������HBr��Br2������cΪ�����ܣ����ˮ��Ϊ�¿ڣ���2���屽�ᴿ�ķ����ǣ���ˮϴ���ѿ������ܽ���ˮ�У�Ȼ����˳�ȥδ��Ӧ����м���ټ�NaOH��Һ����δ��Ӧ��Br2���NaBr��NaBrOϴ��ˮ�У�Ȼ��Ӹ��������ˮ�Ȼ����ܸ����屽���ʴ�Ϊ����ȥHBr��δ��Ӧ��Br2��������������е�ˮ�֣���3��������������������屽�л����е���Ҫ����Ϊ�������÷е㲻ͬ�����ķе�С������������屽����ĸҺ�У����Բ�ȡ����ķ��������屽�뱽����ѡC��
������a��������������ƿ��������������������������Ʒ�Ӧ����������ˮ���廯�ƺ�ˮ���嵥�ʺ��������Ʒ�Ӧ������������ˮ���廯�ƺʹ������ƣ�װ��d�е�����������HBr��Br2������cΪ�����ܣ����ˮ��Ϊ�¿ڣ���2���屽�ᴿ�ķ����ǣ���ˮϴ���ѿ������ܽ���ˮ�У�Ȼ����˳�ȥδ��Ӧ����м���ټ�NaOH��Һ����δ��Ӧ��Br2���NaBr��NaBrOϴ��ˮ�У�Ȼ��Ӹ��������ˮ�Ȼ����ܸ����屽���ʴ�Ϊ����ȥHBr��δ��Ӧ��Br2��������������е�ˮ�֣���3��������������������屽�л����е���Ҫ����Ϊ�������÷е㲻ͬ�����ķе�С������������屽����ĸҺ�У����Բ�ȡ����ķ��������屽�뱽����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���dz��е���Ҫ������Ⱦ��о���������β����Ϊ������������Ҫ�����������ϰ�װ��Ч��ת��������ʹ����β���е���Ҫ��Ⱦ��������Ӧ�����������ʣ�����ʹ������ȼ�ϵ����������������������β����Ⱦ��
��1��H2��CO���Դ���ԭNO�Դﵽ������Ⱦ��Ŀ�ģ�
��֪��N2��g��+O2��g��=2NO��g����H=+180.5kJmol��1
2H2��g��+O2��g��=2H2O��l����H=��571.6kJmol��1
��H2��g����NO��g����Ӧ����N2��g����H2O��l�����Ȼ�ѧ����ʽ�� ��
��2��������һ��ʱ�������������ı���������ѧ��Ӧ���ʣ�ͼ��ʾ��������������ʱ����Ӧ��2CO��g��+2NO��g��2CO2��g��+N2��g�� ��NO��Ũ��[c��NO��]���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߣ�
�ٸ÷�Ӧ�ġ�H0 ���������������
���������ı����S1��S2 �� ����ͼ�л���c ��NO�� ��T1��S2�����´ﵽƽ������еı仯���� �� 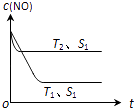
��3����ij�¶�ʱ������������̽��ij�ִ��������µķ�Ӧ���ʣ������崫������ò�ͬʱ���NO��COŨ�������![]()
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
c ��NO������10��3 molL��1�� | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
c ��CO������10��3 molL��1�� | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
�������¶ȱ仯�Դ�����Ч�ʵ�Ӱ�죬��Ҫ��������¼��㣨д��������̣�ֻд���������IJ����֣����ټ���ǰ2s�ڵġ�c ��CO2����
�ڼ���ǰ2s�ڵ�ƽ����Ӧ����v ��N2����
�ۼ���ﵽƽ��ʱNO��ת���ʣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ���ʽṹ�����ʵ���Ҫ���ߣ���ͼ��Ԫ�����ڱ���һ���֣������Ԫ �آ٩����ڱ��е�λ�ûش��������⣮ 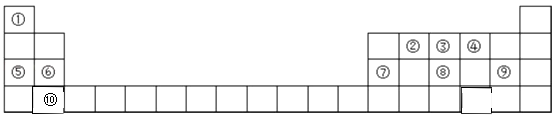
��1������ 10 ��Ԫ���У�ԭ�Ӱ뾶����������Ԫ�ط��ţ���
��2���ࡢ�������������Ӧˮ���������ǿ��˳���� �� ���ѧʽ��
��3��д�����γɵĵ��ʺ�ˮ��Ӧ�����ӷ���ʽ ��
��4��д���١���Ԫ����ɵĻ�����ĵ���ʽ���� ��
��5���ܢݢޢ߶�Ӧ�����Ӱ뾶��С�����������ӷ��ţ���
��6��д��ʵ������ȡ�۵���̬�⻯��Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȤС��Ϊ̽��ij�����Ͻ𣨺Ͻ�Ԫ��Ϊ Mg��Al���Ƿ���Ϲ������������� �ҹ涨�������������ܵ��� 78%���������ͼ��ʾװ�ý���ʵ�飮 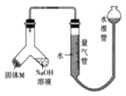
��1����μ����װ�õ������ԣ�
��2���Ͻ���Ʒ���� M ������������Һ��Ӧ�����ӷ���ʽ�� ��
��3����б���װ��ʹ����������Һ��������������Ϊ a �ĺϽ��ĩ������ M����ַ�Ӧ������Ӧֹͣ������������������Ϊ V mL��������ɱ�״������������������� Ϊ 50mL������� M ����������[m��Al��]��ΧΪ ��
��4��Ϊ��ȷ�ز���������������ڶ�ȡ��������Һ������Ĺ����У�Ӧע�⣺�ٶ���ʱ �����밼Һ����ʹ���ƽ����
��5���� a=38mg��V=44.8mL����״������ͨ�������֪���úϽ���������������Ϊ����ȷ��С����� 1 λ����
��6������װ���е�����������Һ�滻Ϊ���������ᣬ��Ӧֹͣ��������������������������������=����V��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X��Y��Z����Ԫ�ص������У���ȷ���ǣ� �� 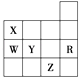
A.��ѹ������Ԫ�صĵ�����Z���ʵķе����
B.Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ
C.W���⻯�ﻹԭ��С��Y���⻯��
D.YԪ�صķǽ����Ա�WԪ�صķǽ�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����373Kʱ���ܱ������г���һ������NO2��SO2 �� �������·�Ӧ��NO2+SO2 ![]() NO+SO3 �� ƽ��ʱ������������ȷ���ǣ� �� ��NO��SO3 �����ʵ���һ�����
NO+SO3 �� ƽ��ʱ������������ȷ���ǣ� �� ��NO��SO3 �����ʵ���һ�����
��NO2��SO2�����ʵ���һ�����
����ϵ�е������ʵ���һ�����ڷ�Ӧ��ʼʱ�����ʵ���
��SO2��NO2��NO��SO3 �����ʵ���һ����ȣ�
A.�ٺ͢�
B.�ں͢�
C.�ٺ͢�
D.�ۺ͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ�������ڱ��е�λ����ͼ������ֻ��MΪ����Ԫ�أ�����˵������ȷ���ǣ��� ����
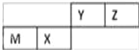
A. ԭ�Ӱ뾶Z��M
B. Zλ��Ԫ�����ڱ��еڶ����ڡ�����A��
C. X�������̬�⻯������ȶ��Ա�Z��С
D. X���ʵ��۵��Y���ʵ��۵��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪԪ�����ڱ���һ���֣�
�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | |
һ | �� | |||||||
�� | �� | �� | �� | �� | �� | |||
�� | �� | �� | �� | �� | ||||
�� | ||||||||
��1������Ԫ���ķǽ�������ǿ��Ԫ���Ľ�������ǿ��Ԫ���ĵ��������³�Һ̬����дԪ�ط��ţ���
��2������Ԫ�آߵ�ԭ�ӽṹʾ��ͼΪ
��3������Ԫ�آޢ��⻯����ȶ���˳��Ϊ������д��ѧʽ����ͬ����
��4������Ԫ�آ������������Ӧˮ��������ԣ��� ��
��5������Ԫ�آں͢�����������Ӧˮ����ļ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йض������ȼ��飨CF2Cl2����������ȷ����
A.�ǷǼ��Է���B.�����������ͷ���
C.ֻ��һ�ֽṹD.�����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com