
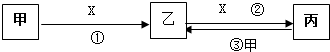
分析 (1)X为产生温室郊应的一种气体,则X为CO2,甲、乙和丙均是含有同一种金属元素的碱性化合物,乙和丙是厨房中常用的物质,则甲为NaOH,乙为Na2CO3,丙为NaHCO3;
(2)甲是一种黄绿色的气体单质,则甲为Cl2,若甲、乙和丙均含有同一种非金属元素,且X是一种常见的金属,且三个反应均属于化合反应,乙为FeCl3,丙为FeCl2,X为Fe;
(3)若甲、乙和丙也均含有同一种元素(此元素为地壳中含量最多的金属元素即为铝元素),且甲是一种常用于净化水的复盐,乙是一种可用于治疗胃酸过多的物质,则甲为KAl(SO4)2,乙为Al(OH)3,丙为NaAlO2,X为NaOH,据此答题.
解答 解:根据题中各物质转化关系,
(1)X为产生温室郊应的一种气体,则X为CO2,甲、乙和丙均是含有同一种金属元素的碱性化合物,乙和丙是厨房中常用的物质,则甲为NaOH,乙为Na2CO3,丙为NaHCO3,反应③离子反应方程式为 CO32-+CO2+H2O=2HCO3-,物质丙常用作发酵粉,
故答案为:CO32-+CO2+H2O=2HCO3-;用作发酵粉;
(2)甲是一种黄绿色的气体单质,则甲为Cl2,若甲、乙和丙均含有同一种非金属元素,且X是一种常见的金属,且三个反应均属于化合反应,乙为FeCl3,丙为FeCl2,X为Fe,反应②离子反应方程式为 2Fe2++Cl2=2Cl-+2Fe3+,物质丙常用作印刷铜电路板的“腐蚀”液,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe2++Cl2=2Cl-+2Fe3+;2Fe3++Cu=2Fe2++Cu2+;
(3)若甲、乙和丙也均含有同一种元素(此元素为地壳中含量最多的金属元素即为铝元素),且甲是一种常用于净化水的复盐,乙是一种可用于治疗胃酸过多的物质,则甲为KAl(SO4)2,乙为Al(OH)3,丙为NaAlO2,X为NaOH,往丙的溶液中通入过量CO2反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
点评 本题考查无机物的推断,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意元素化合物知识的积累,把握常见物质的性质,难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 称量NaOH固体时,放在烧杯中且称量较慢 | |
| B. | 定容时,俯视刻度线 | |
| C. | 定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出 | |
| D. | 移液前,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. 、
、 (任意一种).
(任意一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打检验面团发酵产生的酸 | |
| B. | 用碘酒证明马铃薯中含有淀粉 | |
| C. | 用食醋除去热水瓶中的水垢 | |
| D. | 用淀粉直接检验加碘盐中含的碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | Cu2+ | C. | Mg2+ | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )| A. | a、c两点沉淀物成份不相同,d、e两点沉淀物成份相同 | |
| B. | b点溶液的中c(Na+)=c(C1-) | |
| C. | b-c段与c-d段溶液中阴离子的物质的量相等 | |
| D. | 在d点,向溶液中加入少量盐酸,沉淀量将减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ |
| 物质微粒数 | 固体体积 | 溶液中溶质的质量分数 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
| A. | ①②⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com