
(14分)
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是 ,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚(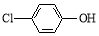 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
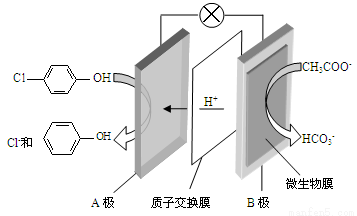
①B是电池的 极(填“正”或“负”);②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。
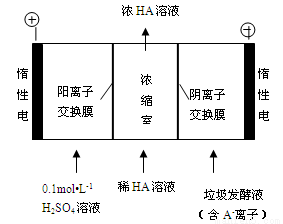
①阳极的电极反应式为 。
②简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g?L-1乳酸溶液通电一段时间后,浓度上升为145 g?L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g? mol-1)
(14分)
(1)①C和N的原子电子层数相同(同周期),核电荷数C小于N,原子半径C大于N(吸引电子能力C弱于N)
注:以递变规律的方式表述也给分。如“C和N同周期,C在N的左边。同周期元素从左至右核电荷数逐渐增多,原子半径逐渐减小,核对最外层电子的引力逐渐减弱”)
② 2CN-+ 4H2O + O2  2HCO3- + 2NH3
2HCO3- + 2NH3
(2)①负;②Cl- -OH + 2e- + H+ ===
-OH + 2e- + H+ ===  -OH + Cl-
-OH + Cl-
(3)①4OH--4e-=== 2H2O+O2↑
② 阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室(1分);A-通过阴离子交换膜从阴极进入浓缩室(1分),H+ +A- === HA,乳酸浓度增大。
③ 6.72
【解析】
试题分析:(1)①C和N的原子电子层数相同,核电荷数C小于N,原子半径C大于N,所以N吸引电子的能力强于C,表现为负价;
②,CN-能够被氧气氧化成HCO3-,同时生成NH3,根据所给反应物和生成物判断反应物中应有水参与,该反应的离子方程式为2CN-+ 4H2O + O2  2HCO3- + 2NH3
2HCO3- + 2NH3
(2)①HCO3-中C为+4价,CH3COO-中C平均为0价,化合价升高,发生氧化反应,所以B极为负极;
②A极发生还原反应,对氯苯酚结合氢离子生成苯酚和氯离子,电极反应式为Cl- -OH + 2e- + H+ ===
-OH + 2e- + H+ ===  -OH + Cl-
-OH + Cl-
(3)①阳极的电极反应式为
考点:考查化学基本原理,物质结构、电化学基础知识


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014北京市西城区高三二模理综化学试卷(解析版) 题型:推断题
(17分)
铃兰醛具有甜润的百合香味,常用作肥皂、洗涤剂和化妆品的香料。合成铃兰醛的路线如下图所示(部分试剂和条件未注明):
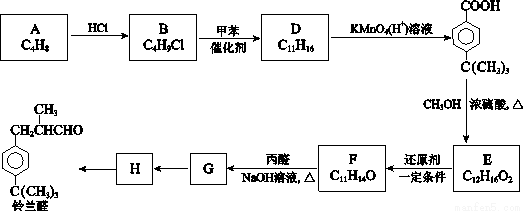
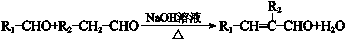
已知:i.
ii.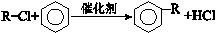
请回答:
(1)由A生成B的反应类型是 。
(2)D的结构简式是 。
(3)生成E的化学方程式是 。
(4) F 能发生银镜反应,F的结构简式是 。
(5)下列有关G的叙述中,不正确的是 。
a.G分子中有4种不同化学环境的氢原子
b.G能发生加聚反应、氧化反应和还原反应
c.1 mol G最多能与4 mol H2发生加成反应
(6)由H生成铃兰醛的化学方程式是 。
(7)F向G转化的过程中,常伴有分子式为C17H22O的副产物K产生。K的结构简式是 。
(8)以有机物A、苯酚、甲醛及必要的无机物为原料合成某高分子树脂,
其结构为  ,合成路线是 。
,合成路线是 。
示例: 
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高一年级期末考试化学试卷(解析版) 题型:填空题
(10分)下表为元素周期表的—部分,请参照元素①一⑨在表中的位置,回答下列问题。

(1)第三周期中元素非金属性最强的元素的原子结构示意图是___________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是___________(填化学式)。
(3)用电子式表示⑨的氢化物的形成过程:_________________________________。
(4)下列可以判断⑤和⑥金属性强弱的是______________________(填序号)。
A.单质的熔点⑤比⑥低 B.化合价⑤比⑥低
C.单质与水反应⑤比⑥剧烈 D.最高价氧化物的水化物的碱性⑤比⑥强
(5)含有上述元素的物质间存在以下转化:
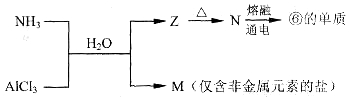
A.M的化学式是___________。
B.N生成⑥的单质反应的化学方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高一年级期末考试化学试卷(解析版) 题型:选择题
下列对应符号表述正确的是
A.一氯甲烷的结构式CH3C1B.苯的分子式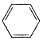
C.葡萄糖的结构简式C6H12O6 D.丙烷分子的球棍模型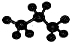
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高一年级期末考试化学试卷(解析版) 题型:选择题
月球上含有丰富的He。关于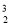 He的说法不正确的是
He的说法不正确的是
A.是一种核素B.原子核内有1个中子
C.与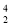 He互为同位素D.比
He互为同位素D.比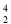 He少一个电子
He少一个电子
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市海淀区高三第二学期二模理综化学试卷(解析版) 题型:选择题
下列事实不能用平衡移动原理解释的是
A.钢铁在潮湿的空气中比在干燥空气中更容易生锈
B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3
C.蒸馏水和0.1 mol?L-1 NaOH溶液中的c(H+),前者大于后者
D.向含有少量Fe3+的MgCl2酸性溶液中加入MgCO3,可将Fe3+转化成Fe(OH)3除去
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市朝阳区高三二模理综化学试卷(解析版) 题型:简答题
(13分)
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是_______。
(2)为便于储存,要将氯气液化[ Cl2(g) 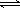 Cl2(l) ],应采取的措施是_______(写出一条即可)。
Cl2(l) ],应采取的措施是_______(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
危险性 |
|
储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
包装 | 钢瓶 |
① 用离子方程式表示“泄漏处理”中NaHSO3溶液的作用_______。
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下:

Cl2在Pt电极放电的电极反应式是_______。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:

(已知:P2O5 + 3H2O = 2H3PO4;Cl2与P2O5不反应。)
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市第二学期期中测试高二化学试卷(解析版) 题型:填空题
(12分)按要求回答下列问题。
(1)根据系统命名法,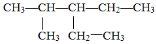 的名称是 ;
的名称是 ;
(2)羟基的电子式是 ;(3)顺-2-丁烯的结构简式是 ;
(4)相对分子质量为72且沸点最低的烷烃的结构简式 ;
(5)2,3-二甲基-2-戊烯的键线式 ;
(6)4,4,5-三甲基-2-己炔的结构简式 .
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:选择题
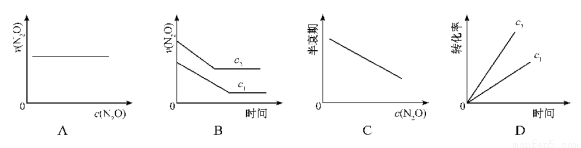
在一定条件下,N2O分解的部分实验数据如下:

下图能正确表示该反应有关物理量变化规律的是
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
 、
、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com