
| A、Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 |
| B、在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高 |
| C、第2周期元素的最高正化合价都等于其原子的最外层电子数 |
| D、非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
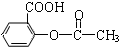 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯 冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
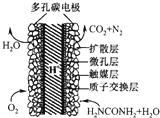 电化学化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,下列关于该电池描述正确的是( )
电化学化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电.尿素燃料电池结构如图所示,下列关于该电池描述正确的是( )| A、电池工作时H+移向负极 |
| B、该装置还可以将电能转化成为化学能 |
| C、电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
| D、理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L KMnO4溶液:K+、Na+、I-、Cl- |
| B、能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3- |
| C、加入KSCN显红色的溶液:K+、Mg2+、Cl-、SO42- |
| D、水电离出c(OH-)=10-5mol/L的溶液:Na+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳与浓硝酸 |
| B、铜与浓硫酸 |
| C、锌与稀硫酸 |
| D、二氧化锰与浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g金属钠变为钠离子时失去的电子数是0.1NA |
| B、标准状况下,11.2L四氯化碳所含分子数为0.5NA |
| C、32g氧气所含原子数为2NA |
| D、18g水所含的质子总数为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯聚合为聚乙烯高分子材料 |
| B、甲烷与氯气制备一氯甲烷 |
| C、以铜和浓硝酸为原料生产硝酸铜 |
| D、乙醇催化氧化制乙醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com