
| A.0molS02 | B.2molS03 | C.1mol02 | D.1molSO3 |
科目:高中化学 来源:不详 题型:填空题
 B(g)+ C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始量都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+ C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始量都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有时焓变对反应的方向起决定作用 |
| B.有时熵变对反应的方向起决定作用 |
| C.焓变和熵变是判断反应的两个主要因素 |
| D.任何情况下,温度都不可能对反应的方向起决定性作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2molH2已耗尽 |
| B.3molI2(g)已耗尽 |
| C.HI的物质的量等于4mol |
| D.HI的物质的量少于4mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.多余的氧气中 |
| B.生成的三氧化硫中 |
| C.氧气和二氧化硫中 |
| D.二氧化硫、氧气和三氧化硫中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 1 |
| 2 |
| A.+131.3kJ?mol-1 | B.-131.3kJ?mol-1 |
| C.+373.1kJ?mol-1 | D.-373.1kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
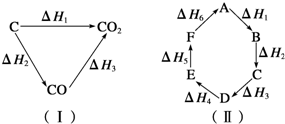
| A.A→F△H=-△H6 |
| B.A→D△H=△H1+△H2+△H3 |
| C.△H1+△H2+△H3+△H4+△H5+△H6=0 |
| D.△H1+△H6=△H2+△H3+△H4+△H5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中, |
D.混合溶液中, |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com