
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
【答案】B
【解析】试题分析:A、由图及离子反应可知x-y的值即为Al(OH)3的物质的量,则设Al(OH)3的物质的量为n,根据Al(OH)3+OH-═AlO2-+2H2O,有![]() =
=![]() ,解得n=0.01mol,即x-y=0.01mol,故A说法正确;B、由图可知,加入33mLNaOH溶液时Cl-离子以NaCl存在,设Cl-离子的物质的量为z,由钠和氯原子守恒可知NaOH~NaCl~Cl-,有
,解得n=0.01mol,即x-y=0.01mol,故A说法正确;B、由图可知,加入33mLNaOH溶液时Cl-离子以NaCl存在,设Cl-离子的物质的量为z,由钠和氯原子守恒可知NaOH~NaCl~Cl-,有![]() =
=![]() ,解得z=0.165mol,则原溶液中Cl-的物质的量浓度为
,解得z=0.165mol,则原溶液中Cl-的物质的量浓度为![]() =0.825mol/L,故B说法不正确;C、由图0~4mL时发生H++OH-═H2O,则H+的物质的量为4mL×0.001L×5molL-1=0.02mol,H+的物质的量浓度为
=0.825mol/L,故B说法不正确;C、由图0~4mL时发生H++OH-═H2O,则H+的物质的量为4mL×0.001L×5molL-1=0.02mol,H+的物质的量浓度为![]() =0.1mol/L,则pH=1,故C说法正确;D、由4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,则根据Al3++3OH-═Al(OH)3↓,反应的氢氧根离子的物质的量为0.03mol,设镁离子的物质的量为m,由Mg2++2OH-═Mg(OH)2↓,有
=0.1mol/L,则pH=1,故C说法正确;D、由4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,则根据Al3++3OH-═Al(OH)3↓,反应的氢氧根离子的物质的量为0.03mol,设镁离子的物质的量为m,由Mg2++2OH-═Mg(OH)2↓,有![]() =
=![]() ,解得m=0.05mol,则原溶液中n(Mg2+):n(Al3+)=0.05:0.01=5:1,故D说法正确;故选B。
,解得m=0.05mol,则原溶液中n(Mg2+):n(Al3+)=0.05:0.01=5:1,故D说法正确;故选B。


科目:高中化学 来源: 题型:
【题目】25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,下列热化学方程式书写正确的是( )
A. 1/2Ba(OH)2(aq)+1/2H2SO4(aq)![]() 1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
B. 1/2KOH(aq)+H2SO4(aq)![]() 1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 2NaOH(aq)+H2SO4(aq)![]() Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
D. KOH(aq)+1/2H2SO4(浓)![]() 1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是___________________________________。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于_________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_________。(提示:ΔH=-![]() ,保留一位小数)。
,保留一位小数)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(6)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现榨的苹果汁在空气中会由浅绿色变为棕黄色,你猜测可能的原因是
A.苹果汁中含有Cu2+B.苹果汁中含有OH﹣
C.苹果汁中含有Na+D.苹果汁中的Fe2+变成Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温下,Fe 与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe 与水蒸气反应的实验"。请回答该实验中的问题。

(1)写出该反应的化学方程式__________。
(2)实验前必须对整套装置进行的操作是___________;
(3)在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①实验中使用肥皂液的作用是_____________________________。
②甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验。
实验 编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质是__________________________;不能确定是否存在FeO的原因是____________________________________。
③如果黑色粉末是Fe3O4,则黑色粉末和盐酸反应得离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属元素的叙述不正确的是
A.原子最外层都只有1个电子B.随核电荷数增加,原子半径增大
C.在空气中燃烧都生成过氧化物D.随核电荷数增加,与水反应的剧烈程度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷的球棍模型如图所示,下列有关说法不正确的是
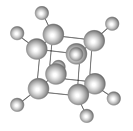
A. 其一氯代物只有一种
B. 其二氯代物有三种同分异构体
C. 它与苯乙烯( C6H4-CH=CH2)互为同分异构体
D. 它与2,3,5-三甲基一3-乙基己烷互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)有多种化合物.在高压条件下.采用钴碘催化循环法制备醋酸过程如图所示。
(1)一种锂钴复合氧化物晶体的结构如图所示,其化学式为___________。

(2)下图表示的总反应的化学方程式为______________________。
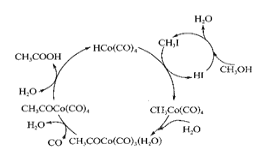
(3)基态Co原子的价电子排布图为______________。
(4)1个CH3COCo(CO)4分子中含有![]() 键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
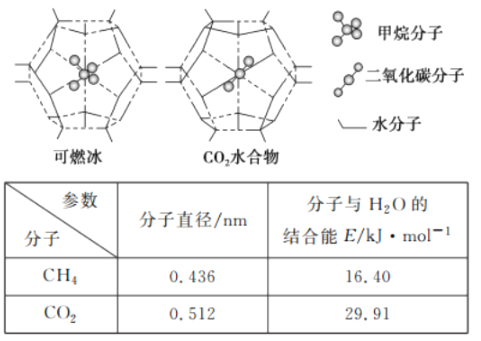
(5)CH4、CO2是合成CH3OH的基本原料。一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 CH4与H2O形成的水合物晶体.俗称“可燃冰”。为开采深海海底的“可燃冰’,有科学家提出用以CO2换CH4的设想。已知下图中笼状结构的空腔直径为0.586 nm.结合图表从物质结构及性质的角度分析,该设想的依据是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com