
| A. | 1mol甲基含10NA个电子 | |
| B. | 标准状况下,11.2L三氯甲烷所含的分子数目为0.5NA | |
| C. | 一定条件下,2.6g乙炔、苯和苯乙烯的气态混合物所含碳原子数为0.2NA | |
| D. | 0.5mol聚1,3-丁二烯分子中含有C=C双键数为0.2NA |
分析 A、甲基中含9个电子;
B、标况下三氯甲烷为液态;
C、乙炔、苯和苯乙烯的最简式均为CH;
D、聚1,3-丁二烯分子中聚合度n的值不明确.
解答 解:A、甲基中含9个电子,故1mol甲基中含9NA个电子,故A错误;
B、标况下三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故B错误;
C、乙炔、苯和苯乙烯的最简式均为CH,故2.6g混合物中含有的CH的物质的量为0.2mol,则含0.2NA个碳原子,故C正确;
D、聚1,3-丁二烯分子中聚合度n的值不明确,故0.5mol聚1,3-丁二烯中含有的碳碳双键个数无法确定,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现象 | 结论 |
| A | 将浓硫酸滴到胆矾晶体上 | 晶体逐渐变成白色 | 该过程发生物理变化 |
| B | 将过量过氧化钠固体投入紫色石蕊试液中 | 溶液变成蓝色 | 过氧化钠与水反应生成氢氧化钠,溶液呈碱性 |
| C | 向硝酸亚铁溶液中滴入稀硫酸 | 无明显现象 | 硝酸亚铁与硫酸不反应 |
| D | 将滴有酚酞的氨水加热 | 红色逐渐变浅 | 一水合氨受热分解,导致溶液碱性减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
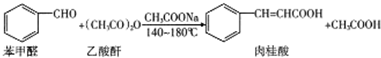
| 名称 | 分子量 | 相对密度 | 熔点 | 沸点 | 溶解度 |
| 苯甲醛 | 106 | 1.04 | -26 | 179.62 | 微溶于水,可混溶于乙醇、乙醚、苯 |
| 乙酸酐 | 102 | 1.080 | -73.1 | 138.6 | 溶于乙醚,易水解形成乙酸. |
| 肉桂酸 | 148 | 1.247 | 135 | 300 | 微溶于水,可以溶于苯、丙酮、乙醚、乙醇等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强 | |
| B. | X原子的得电子能力比Y原子的得电子能力强 | |
| C. | X的阴离子的还原性比Y的阴离子的还原性强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3:0.12 mol•L-1 | B. | H2O:0.09 mol•L-1 | ||
| C. | NO:0.03 mol•L-1 | D. | O2:0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3+H2O→H2SO4 | B. | Cl2+H2O?HCl+HClO | ||
| C. | 2 F2+2 H2O→4 HF+O2 | D. | 2 Al+6 H2O$\stackrel{△}{→}$2 Al(OH)3+3 H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5 g | |
| B. | 0.5 mol CO2气体中所含的CO2分子数约为3.01×1023 | |
| C. | 标准状况下,6.02×1022个CO2分子所占的体积约是22.4 L | |
| D. | 在1 L水中溶解5.85g NaCl,即可配制得0.1 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3) | B. | (2)(4) | C. | (1)(2)(4)(6) | D. | (2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
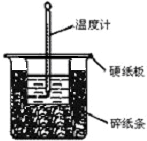 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 温度 序号 | 起始温度t1/℃ | 终止温度 T2/℃ | 温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com