
分析 (1)硫酸为二元强酸,一步完全电离;(2)碳酸为二元弱酸,分步电离;(3)乙酸为一元弱酸,部分电离;(4)氢氧化钡为二元强碱,一步完全电离;(5)氢氧化铁为三元弱碱,部分电离;(6)一水合氨为一元弱碱,部分电离;(7)硫酸铜为盐,完全电离.
解答 解:(1)硫酸为强电解质,完全电离,电离方程式:H2SO4=2H++SO42-,
故答案为:H2SO4=2H++SO42-;
(2)H2CO3是弱电解质,在水溶液里不能完全电离,属于二元弱酸,分步电离,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,
故答案为:H2CO3?H++HCO3-,HCO3-?H++CO32-;
(3)醋酸为弱电解质,部分电离,电离方程式:CH3COOH?CH3COO-+H+,
故答案为:CH3COOH?CH3COO-+H+;
(4)氢氧化钡为强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,
故答案为:Ba(OH)2=Ba2++2OH-;
(5)氢氧化铁为弱电解质,部分电离生成三价铁离子与氢氧根离子,电离方程式为:Fe(OH)3?Fe3++3OH-,
故答案为:Fe(OH)3?Fe3++3OH-;
(6)一水合氨为弱电解质,部分电离出铵根离子和氢氧根离子,电离方程式为NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(7)硫酸铜为盐,是强电解质,完全电离,电离方程式:CuSO4=Cu2++SO42-;
故答案为:CuSO4=Cu2++SO42-.
点评 本题考查了电离方程式的书写,明确电解质的强弱及电离方程式的书写规则是解本题关键,注意原子团不能拆开、弱酸弱碱部分电离,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向2mol/L的醋酸溶液中加入镁条,产生气泡的速率先加快再减慢 | 反应刚开始时,醋酸电离平衡正移,c(H+)增大 |
| B | 常温下分别测等浓度的醋酸和氨水pH,发现二者的pH之和为14 | 常温下,醋酸和氨水的电离平衡常数相等 |
| C | 向均盛有2mL5%H2O溶液的两支试管中分别滴入0.2mol/LFe3+,和0.3mol/LCu2+溶液1mL,前者生成气泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| D | 向硼酸(H3BO3)溶液中滴加少量Na2CO3溶液,观察到无明显现象 | H3BO3的酸性弱于H2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
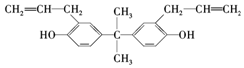 双酚A也称BPA(结构如图所示),严重威胁着胎儿和儿童的健康,甚至癌症和新陈代谢紊乱导致的肥胖也被认为与此有关.下列关于双酚A的说法正确的是( )
双酚A也称BPA(结构如图所示),严重威胁着胎儿和儿童的健康,甚至癌症和新陈代谢紊乱导致的肥胖也被认为与此有关.下列关于双酚A的说法正确的是( )| A. | 该化合物的化学式为C20H22O2 | |
| B. | 该化合物能与三氯化铁溶液发生显色反应 | |
| C. | 该化合物的所有碳原子处于同一平面 | |
| D. | 1 mol双酚A最多可与4 mol Br2(溴水)发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 8:7 | C. | 2:3 | D. | 7:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 1-丁稀 | C. | 1,3-丁二烯 | D. | 乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 利用Ca(OH)2溶液鉴别Na2CO3和NaHCO3两溶液 | 有沉淀生成的是Na2CO3 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| D | 切开金属钠,钠表面的银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 密度 | C. | 质量 | D. | H的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (4)(5)(8) | B. | (1)(4)(5)(7)(8) | C. | (4)(5)(7)(8) | D. | (2)(3)(4)(5)(8) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com