
| A、当温度升高时,弱酸的电离平衡常数Ka变小 |
| B、某温度下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L |
| C、由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
| D、常温下,pH=12氨水与pH=2盐酸等体积混合c(Cl-)>c(NH+4)>c(H+)>c(OH-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
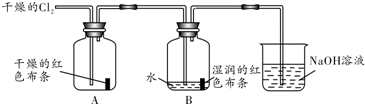
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||||
| B、强电解质中不含共价键 | ||||||
| C、25℃时,pH=9的Na2CO3溶液和pH=5的AlCl3溶液中,水的电离程度相同 | ||||||
| D、25℃时,pH=4.75、浓度均为0.1mol?L-1的CH3COOH、CH3COONa的c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)混合溶液: |
查看答案和解析>>
科目:高中化学 来源: 题型:
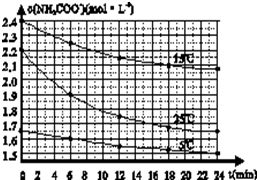 某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )| A、0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B、c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C、25℃时0~6 min,v(NH2COO-)为0.05 mol?L-1?min-1 |
| D、15℃时,第30 min时,c(NH2COO-)为2.0 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
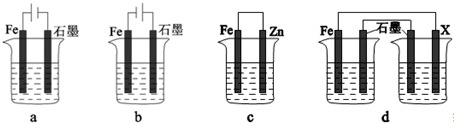
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物 |
| B、棉花、木材和羊毛的主要成分都是纤维素 |
| C、pH在5.6-7.0之间的降水通常称为酸雨 |
| D、汽油、植物油、甘油都有特殊的香味,都是酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
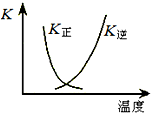 把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3
把a molO2和b mol SO2气体充入一密闭容器中,高温条件下发生反应O2+2SO2?2SO3| X |
| Y |
| 1 |
| 4 |
| X |
| Y |
| 2 |
| 3 |
| X |
| Y |
| 1 |
| 4 |
| X |
| Y |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成纤维和光导纤维都是新型无机非金属材料 |
| B、乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 |
| C、淀粉、纤维素的化学式都可表示为(C6H10O5)n,二者互为同分异构体 |
| D、乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com