
 有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验:
有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验:分析 加入浓溴水,溶液变为黄褐色,说明生成碘,则含有I-,Fe3+能把I-氧化为碘单质,淀粉遇碘变蓝色,溶液未变蓝说明无Fe3+,由图象可知氢氧化钠溶液先后分别与H+、Mg2+和Al3+、NH4+、Al(OH)3反应,则不含Mg2+,故溶液中一定含有H+、Al3+、NH4+,因沉淀完全溶解,三种离子均可与CO32-发生反应,因此溶液中无CO32-,结合对应图象的数据计算各离子的物质的量,以此解答该题.
解答 解:加入浓溴水,溶液变为黄褐色,说明生成碘,则含有I-,Fe3+能把I-氧化为碘单质,淀粉遇碘变蓝色,溶液未变蓝说明无Fe3+,由图象可知氢氧化钠溶液先后分别与H+、Mg2+和Al3+、NH4+、Al(OH)3反应,则不含Mg2+,故溶液中一定含有H+、Al3+、NH4+,因沉淀完全溶解,三种离子均可与CO32-发生反应,因此溶液中无CO32-,
氢氧化钠与氢离子反应消耗的物质的量为:1mol•L-1×0.01L=0.01mol,因此n(H+)=0.01mol;
溶解氢氧化铝消耗的氢氧化钠的物质的量为1mol•L-1×0.01L=0.01mol,因此n(Al3+)=n[Al(OH)3]=0.01mol;
与铵根离子反应的氢氧化钠的物质的量为1mol•L-1×0.02L=0.02mol,则n(NH4+)=0.02mol,
溶液存在n(H+)+3n(Al3+)+n(NH4+)=n(I-),则n(I-)=0.01mol+0.01mol×3+0.02mol=0.06mol,
故答案为:H+0.01mol、Al3+ 0.01mol、NH4+ 0.02mol、I-0.06mol.
点评 本题考查离子的检验,侧重于学生的分析、计算能力的考查,对于图象分析题的解题规律:要明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物与浓溴水可发生取代反应 | |
| B. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 该有机物能与Na、Na2CO3、NaHCO3溶液发生反应 | |
| D. | 该有机物经催化氧化后与银氨溶液水浴加热,可生成光亮的银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为工业上氯碱工业的电解槽示意图,据图回答:
如图为工业上氯碱工业的电解槽示意图,据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.1molN5+离子中所含的电子数为3.4NA | |
| C. | 5.6g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 用溶有1molFeCl3的饱和溶液制Fe(OH)3胶体,制成的胶体中含有的胶粒数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
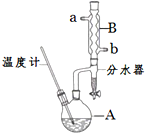 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com