
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3 溶液 | |
| ③ | ||||
| ④ |
分析 (1)实验②和③探究温度对该反应速率的影响,故②③的温度不同,其他条件完全相同;
实验②和④探究H2O2浓度对该反应速率的影响,故②和④的H2O2浓度不同,其他条件相同;
(2)H2O2浓度增大,分解速率加快;
(3)溶液变成蓝色,说明铜被氧化成铜离子,双氧水被还原为水,据此写出反应方程式.
解答 解:(1)实验②和③要探究温度对反应速率的影响,除温度不同外,其他条件要统一,则实验③的温度为40℃,双氧水的浓度与实验②相同,为5%,并要加催化剂氯化铁;实验②和④探究H2O2浓度对该反应速率的影响,除浓度度不同外,其他条件要统一,则实验④的温度为20℃,双氧水的浓度为10%,同样要加催化剂氯化铁,
故答案为:
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | ||||
| ② | ||||
| ③ | 40 | 5 | FeCl3溶液 | |
| ④ | 20 | 10 | FeCl3溶液 |
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,试题侧重考查学生的实验探究能力,明确实验目的为解答关键,注意掌握温度、浓度、催化剂等因素对反应速率的影响.


科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH=7 | |
| B. | 0.1 mol•L-1 NH4Cl 溶液与 0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol AgCl 和 0.1 mol AgI 混合后加入水中,所得溶液 c(Cl-)=c(I-) | |
| D. | 向 0.10 mol•L-1 Na2SO3溶液中通 SO2气体至溶液 pH=7:c(Na+)<2[c(SO23-)+c(HSO3-)+c(H2SO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验内容 | 实验现象 | 有关反应的方程式或结论 |
| ①取磨光后镁条与铝条,分别投入稀盐酸中 | Mg+2HCl=MgCl2+H2↓ 2Al+6HCl=2AlCl3+3H2↓ 说明金属性的强弱顺序为:Mg>Al | |
| ②向MgCl2、AlCl3溶液中分别逐滴滴入NaOH溶液至过量 | 与MgCl2溶液反应产生白色沉淀,与AlCl3溶液反应先产生白色沉淀,而后沉淀完全溶解 | AlCl3溶液与NaOH溶液反应的化学方程式:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O |
| ③向新制的Na2S溶液中滴入新制的氯水 | 生成淡黄色的沉淀 | 反应的化学方程式为:Na2S+Cl2=S↓+2NaCl |
| ④向各为1mol/L的H2SO4、H3PO4溶液中投入镁条 | 镁与H2SO4反应更剧烈,迅速产生大量无色气体 | 说明非金属性的强弱顺序为:S>P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入KHSO4溶液,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小,但还是中性 | |
| C. | 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移动,KW增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
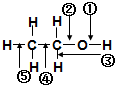
| A. | 和金属钠作用时,键②断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和HBr共热时,键④断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
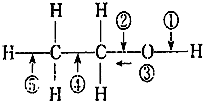
| A. | 和金属钠反应时断裂① | |
| B. | 乙醇燃烧时断裂②和⑤ | |
| C. | 在银催化条件下,与O2反应时断裂①和③ | |
| D. | 和浓H2SO4、乙酸共热时断裂①,其他键不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1mol•L-1氨水的pH为11:NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| B. | 将Na块放入水中,放出气体:2Na+2H2O=2NaOH+H2↑ | |
| C. | 铝片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com