
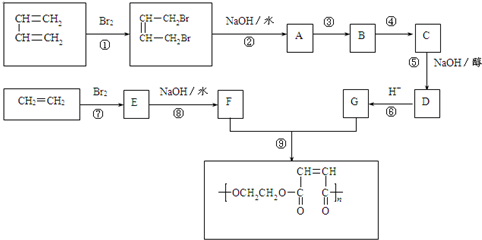
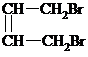 +2NaOH
+2NaOH| 水 |
| △ |
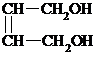 +2NaBr,故答案为:
+2NaBr,故答案为: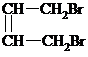 +2NaOH
+2NaOH| 水 |
| △ |
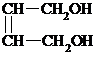 +2NaBr;
+2NaBr;

科目:高中化学 来源: 题型:
| A、该反应可能是化合反应,也可能是氧化还原反应 |
| B、该反应一定是复分解反应,且属于非氧化还原反应 |
| C、该反应可能是CaCl2+Na2CO3═CaCO3↓+2NaCl |
| D、该反应可能是Ca(OH)2+K2CO3═CaCO3↓+2KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
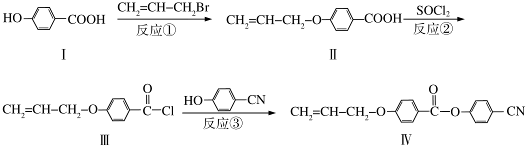
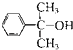 也可与III发生类似反应③的反应生成有机物V,V的结构简式是
也可与III发生类似反应③的反应生成有机物V,V的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的PH>7 |
| B、溶液中c(Na+)=2c(A2-)+c(HA)+c(H2A) |
| C、加水稀释,c(A2-)/c(HA-)减小 |
| D、加入NaOH固体,可使离子浓度满足:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
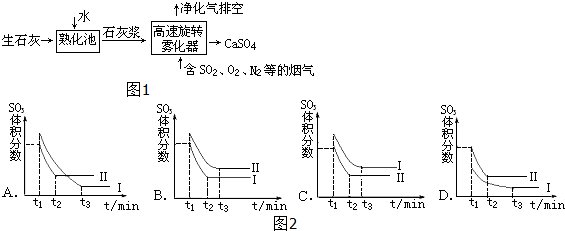
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO3溶液 |
| B、C6H12O6溶液 |
| C、NaCl溶液 |
| D、NH3?H2O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2 O3 | CO | Fe | CO2 | |
| 甲容器 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙容器 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com