
”¾ĢāÄæ”æĮņõ£ĀČ£ØSO2Cl2£©³£ÓĆÓŚÖĘŌģŅ½Ņ©Ę·£¬Č¾ĮĻµČ”£Ä³»ÆѧŠ”×éŌŚŹµŃéŹŅĄūÓĆ“æ¾»øÉŌļµÄĀČĘųŗĶ¶žŃõ»ÆĮņ·“Ó¦ÖĘČ”Įņõ£ĀČ£¬ĖłŠčŹµŃé×°ÖĆČēĶ¼ĖłŹ¾(²æ·Ö×°ÖĆĀŌ)”£
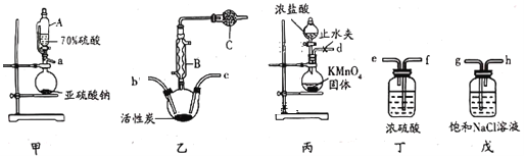
ŅŃÖŖ£ŗ¢ŁĮņõ£ĀČĶس£Ģõ¼žĻĀĪŖĪŽÉ«ŅŗĢ壬ČŪµćĪŖ£54.1”ę£¬·ŠµćĪŖ69.1”ę£¬ŌŚ³±ŹŖµÄæÕĘųÖŠ”°·¢ŃĢ”±£»
¢ŚSO2(g)+Cl2(g)£½SO2Cl2(l)£¬”÷H=£97.3kJ/mol”£
£Ø1£©ŅĒĘ÷AĪŖŗćŃ¹·ÖŅŗĀ©¶·£¬ÓėĘÕĶØ·ÖŅŗĀ©¶·Ļą±Č£¬ĘäÓŵćŹĒ___£»ŅĒĘ÷BµÄĆū³ĘŹĒ___”£
£Ø2£©ÉĻŹö×°ÖƵÄĮ¬½ÓĖ³Šņ£ŗa½Ó £¬ ½Ó £¬ ½Ó £¬ ½Ó £¬ ½Ód”££Ø×°ÖĆæÉŅŌÖŲø“Ź¹ÓĆ£©___
£Ø3£©ĒņŠĪøÉŌļ¹ÜCÖŠµÄŹŌ¼ĮĪŖ___£¬×÷ÓĆĪŖ___”£
£Ø4£©Įņõ£ĀČŌŚ³±ŹŖæÕĘųÖŠ”°·¢ŃĢ”±µÄŌŅņŹĒ___£ØÓĆ»Æѧ·½³ĢŹ½±ķŹ¾£©
£Ø5£©ŌŚĪŽ»īŠŌĢæ“ęŌŚµÄĢõ¼žĻĀSO2ÓėCl2Ņ²æÉ·¢Éś·“Ó¦£¬ĻÖ½«SO2”¢Cl2°“ÕÕŅ»¶Ø±ČĄżĶØČėĖ®ÖŠ£¬ĒėÉč¼ĘŅ»øö×ī¼ņµ„µÄŹµŃé·½°øŃéÖ¤¶žÕߏĒ·ńĒ”ŗĆĶźČ«·“Ó¦£ŗ____”££Ø¼ņŅŖĆčŹöŹµŃé²Ł×÷£¬ĻÖĻóŗĶ½įĀŪ£©ŅĒĘ÷×ŌŃ”£¬æɹ©Ń”ŌńµÄŹŌ¼Į£ŗĖįŠŌøßĆĢĖį¼ŲČÜŅŗ”¢µā»Æ¼ŲČÜŅŗ”¢µķ·ŪČÜŅŗ”¢Ę·ŗģČÜŅŗ”£
”¾“š°ø”æŹ¹ÕōĮóÉÕĘæŗĶŗćŃ¹·ÖŅŗĀ©¶·ÖŠĘųĢåŃ¹ĒæĻąµČ£¬±ćÓŚŅŗĢåĖ³ĄūĮ÷ĻĀ ĒņŠĪĄäÄż¹Ü f£»e£»b£»c£»e£»f£»h£»g ¼īŹÆ»Ņ»ņĒāŃõ»ÆÄĘ ĪüŹÕ¹żĮæµÄSO2»ņCl2£¬·ĄÖ¹ĪŪČ¾æÕĘų£¬·ĄÖ¹æÕĘųÖŠµÄĖ®ÕōĘų½ųČėČż¾±ÉÕĘæŹ¹Įņõ£ĀČĖ®½ā SO2Cl2 +2H2O = H2SO4 + 2HCl ȔɣĮæ·“Ó¦ŗóµÄČÜŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓĘ·ŗģČÜŅŗ£¬Õńµ“£¬ČōČÜŅŗĶŹÉ«£¬Ōņ¶žÕßĪ“ĶźČ«·“Ó¦£»Čō²»ĶŹÉ«£¬Ōņ¶žÕßĒ”ŗĆĶźČ«·“Ó¦
”¾½āĪö”æ
¼××°ÖĆÓĆÓŚÖĘČ”¶žŃõ»ÆĮņĘųĢ壬ŅŅ×°ÖĆŹµĻÖĀČĘųŗĶ¶žŃõ»ÆĮņŌŚøÉŌļ»·¾³ĻĀ·“Ó¦ÖĘĮņõ£ĀČ£¬±ū×°ÖĆÓĆÓŚÖĘČ”ĀČĘų£¬¶”×°ÖĆøÉŌļĘųĢ壬Īģ×°ÖĆÓĆÓŚ³żµōĀČĘųÖŠµÄĀČ»ÆĒāĘųĢåŌÓÖŹ”£
¢ÅŅĒĘ÷AĪŖŗćŃ¹·ÖŅŗĀ©¶·£¬ÓėĘÕĶØ·ÖŅŗĀ©¶·Ļą±Č£¬ĘäÓŵćŹĒŹ¹ÕōĮóÉÕĘæŗĶŗćŃ¹·ÖŅŗĀ©¶·ÖŠĘųĢåŃ¹ĒæĻąµČ£¬±ćÓŚŅŗĢåĖ³ĄūĮ÷ĻĀ£¬øł¾ŻŅĒĘ÷BµÄ¹¹ŌģæÉÖŖŅĒĘ÷BµÄŹĒĒņŠĪĄäÄż¹Ü£¬
¹Ź“š°øĪŖŹ¹ÕōĮóÉÕĘæŗĶŗćŃ¹·ÖŅŗĀ©¶·ÖŠĘųĢåŃ¹ĒæĻąµČ£¬±ćÓŚŅŗĢåĖ³ĄūĮ÷ĻĀ£»ĒņŠĪĄäÄż¹Ü£»
¢ĘÉĻŹö·“Ó¦ŅŖĻČÖʵĆøÉŌļµÄ¶žŃõ»ÆĮņŗĶøÉŌļµÄĀČĘų£¬½«Į½ÖÖĘųĢåĻņÖŠ¼äĶØČėµ½ŅŅ×°ÖĆÖŠ·¢Éś·“Ó¦£¬Ņņ“Ė×°ÖƵÄĮ¬½ÓĖ³Šņ£ŗa½Óf£¬e½Ób£¬c½Óe£¬f½Óh£¬g½Ód£¬
¹Ź“š°øĪŖf£»e£»b£»c£»e£»f£»h£»g£»
¢Ē×°ÖĆCÖŠ²śÉśĮņõ£ĀČ£¬Įņõ£ĀČŌŚ³±ŹŖæÕĘųÖŠ”°·¢ŃĢ”±£¬Cl2”¢SO2¶¼ÓŠ¶¾£¬ĖłŅŌŅŖÓĆ¼īŹÆ»Ņ»ņNaOH·ĄÖ¹æÕĘųÖŠµÄĖ®ÕōĘų½ųČėČż¾±ÉÕĘæŹ¹Įņõ£ĀČĖ®½ā£¬Ķ¬Ź±¼īŹÆ»Ņ»ņNaOHÄÜĪüŹÕĪ“·“Ó¦µÄCl2»ņSO2£¬·ĄÖ¹ĪŪČ¾“óĘų£¬
¹Ź“š°øĪŖ¼īŹÆ»Ņ»ņNaOH£»ĪüŹÕ¹żĮæµÄSO2»ņCl2£¬·ĄÖ¹ĪŪČ¾æÕĘų£¬·ĄÖ¹æÕĘųÖŠµÄĖ®ÕōĘų½ųČėČż¾±ÉÕĘæŹ¹Įņõ£ĀČĖ®½ā£»
¢ČĮņõ£ĀČŌŚ³±ŹŖæÕĘųÖŠ”°·¢ŃĢ”±·“Ӧɜ³ÉŃĪĖįŗĶĮņĖį£¬»Æѧ·½³ĢŹ½ĪŖSO2Cl2 +2H2O =H2SO4 + 2HCl£¬
¹Ź“š°øĪŖSO2Cl2 +2H2O=H2SO4 + 2HCl£»
¢É¶žŃõ»ÆĮņÓėĀČĘų¶¼æÉŅŌĘÆ°×Ę·ŗģČÜŅŗ£¬Čō¶žÕßĒ”ŗĆĶźČ«·“Ó¦µĆµ½ŃĪĖį”¢ĮņĖį£¬²»ÄÜŹ¹Ę·ŗģČÜŅŗĶŹÉ«£¬¹ŹŃéÖ¤¶žÕߏĒ·ńĒ”ŗĆĶźČ«·“Ó¦µÄ·½°øĪŖ£ŗȔɣĮæ·“Ó¦ŗóµÄČÜŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓĘ·ŗģČÜŅŗ£¬Õńµ“£¬ČōČÜŅŗĶŹÉ«£¬Ōņ¶žÕßĪ“ĶźČ«·“Ó¦£»Čō²»ĶŹÉ«£¬Ōņ¶žÕßĒ”ŗĆĶźČ«·“Ó¦£»
¹Ź“š°øĪŖ£ŗȔɣĮæ·“Ó¦ŗóµÄČÜŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓĘ·ŗģČÜŅŗ£¬Õńµ“£¬ČōČÜŅŗĶŹÉ«£¬Ōņ¶žÕßĪ“ĶźČ«·“Ó¦£»Čō²»ĶŹÉ«£¬Ōņ¶žÕßĒ”ŗĆĶźČ«·“Ó¦”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŅ¹śæĘѧ¼Ņ³É¹¦ŹµĻÖĮĖµē½āĘųĢ¬HClÖʱøCl2£¬Ę乤×÷ŌĄķČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ( )
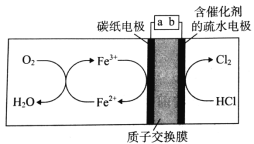
A.aĪŖĶā½ÓÖ±Į÷µēŌ“µÄøŗ¼«
B.Ńō¼«µÄµē¼«·“Ó¦ĪŖ2HCl - 2e- ØT Cl2 + 2H+
C.ĶصēŗóH+“Ó×óŹŅĒØŅĘÖĮÓŅŹŅ
D.×óŹŅÖŠ·¢Éś·“Ó¦ĪŖ4Fe2+ + O2 + 4H+ ØT 4Fe3+ + 2H2O£¬ŹµĻÖĮĖFe3+µÄŌŁÉś
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”涞ĆÆĢś[(C5H5)2Fe]·Ö×ÓŹĒŅ»ÖÖ½šŹōÓŠ»śÅäŗĻĪļ£¬ŹĒČ¼ĮĻÓĶµÄĢķ¼Ó¼Į£¬ÓĆŅŌĢįøßČ¼ÉյĊ§ĀŹŗĶČ„ŃĢ£¬æÉ×÷ĪŖµ¼µÆŗĶĪĄŠĒµÄĶæĮĻµČ”£ĖüµÄ½į¹¹ČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©

A. ¶žĆÆĢśÖŠFe2+Óė»·Īģ¶žĻ©Ąė×Ó(C5H5-)Ö®¼äĪŖÅäĪ»¼ü
B. lmol»·Īģ¶žĻ©(![]() )ÖŠŗ¬ÓŠ
)ÖŠŗ¬ÓŠ![]() ¼üµÄŹżÄæĪŖ11NA
¼üµÄŹżÄæĪŖ11NA
C. ¶žĆÆĢś·Ö×ÓÖŠ“ęŌŚ¦Š¼ü
D. Fe2+µÄµē×ÓÅŲ¼Ź½ĪŖls 22s 22p63s23p63d44s2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮņ“śĮņĖįÄĘ(Na2S2O3)ĪŖ°×É«½į¾§·ŪÄ©£¬Ņ×ČÜÓŚĖ®£¬ŌŚÖŠŠŌ»ņ¼īŠŌĢõ¼žĻĀĪČ¶Ø£¬ŌŚĖįŠŌĢõ¼žĻĀ·¢Éś·“Ó¦(S2O32-+2H+£½S”ż+SO2+H2O)£¬ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Na2S2O3ČÜŅŗæÉÓĆ×÷ÕÕĻąµ×ʬ(AgBr)ÖŠµÄ¶ØÓ°¼Į£¬ĘäŌĄķŹĒ½«Ī“øŠ¹āµÄAgBr×Ŗ»ÆĪŖæÉČÜÓŚĖ®µÄĪȶØĀēŗĻĪļNa3[Ag(S2O3)2]”£Š“³öøĆĀēŗĻ·“Ó¦µÄĄė×Ó·½³ĢŹ½___”£
£Ø2£©¹¤ŅµÉĻĄūÓĆĮņ»Æ¼ī²ŠŌü(Ö÷ŅŖ³É·ÖNa2S£¬Na2CO3)ÓėĮņ»Ę·ĻĘų(Ö÷ŅŖ³É·ÖSO2)·“Ó¦£¬¾ĪüĮņ”¢Õō·¢”¢½į¾§£¬ÖʵĆĮņ“śĮņĖįÄĘ”£ĖČÖŖøĆ·“Ó¦ÖŠC(Ģ¼)Ō×Ó»ÆŗĻ¼Ū²»±ä£¬ŌņŃõ»Æ¼ĮŗĶ»¹Ō¼ĮĪļÖŹµÄĮæÖ®±ČĪŖ___”£
£Ø3£©Na2S2O3³¤ĘŚ±©Ā¶ŌŚæÕĘųÖŠŅ×±»Ńõ»ÆÉś³ÉNa2SO4£¬Éč¼ĘŹµŃé·½°ø¼ģŃéNa2S2O3ŹĒ·ń±äÖŹ(ŅŃÖŖBaS2O3Ī¢ČÜÓŚĖ®)___”£
£Ø4£©ĻÖÓŠŗ¬Na2S2O3”¤5H2OµÄѳʷ£¬ÓĆŅŌĻĀ·½·Ø¼ĘĖćNa2S2O3”¤5H2OµÄÖŹĮæ·ÖŹż”£
a.Ȕѳʷ7.0gČÜÓŚÕōĮóĖ®ÖŠ£¬²¢¶ØČŻÖĮ500mLČŻĮæĘæÖŠ“żÓĆ”£
b.Č”0.01mol.L-1µÄK2Cr2O7±ź×¼ČÜŅŗ20.00mLӌ׶ŠĪĘæÖŠ£¬¼Ó¹żĮæKIČÜŅŗ²¢Ėį»Æ£¬¼Ó2µĪµķ·ŪÖøŹ¾¼Į£¬ÓĆaÖŠĪ“ÖŖÅØ¶ČµÄNa2S2O3“ż²āŅŗµĪ¶ØÖĮÖÕµć£¬¹²ÓĆČ„25.00mL”£(ŅŃÖŖ2S2O32-+I2£½S4O62-+2I-)£¬ŌŚĖįŠŌ»·¾³ÖŠCr2O72-±»»¹ŌĪŖĀĢÉ«µÄCr3+)”£
»ŲČŻĻĀĮŠĪŹĢā£ŗ
¢ŁµĪ¶ØÖÕµćµÄĻÖĻóŹĒ___”£
¢ŚŃłĘ·ÖŠNa2S2O3”¤5H2OµÄÖŹĮæ·ÖŹżĪŖ___(±£Įō2Ī»ÓŠŠ§Źż×Ö)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫Ģæ·ŪŗĶĢś·Ū¾łŌČ»ģŗĻ£¬ČöČėÄŚ±Ś·Ö±šÓĆĀČ»ÆÄĘČÜŅŗŗĶĻ”“×ĖįČÜŅŗČóŹŖ¹żµÄ¾ßÖ§ŹŌ¹ÜÖŠ£¬²¢°“ČēĶ¼×°ÖĆŗĆŅĒĘ÷£¬¹Ū²ģĶ¼Ļń£¬Ź¾ŅāÕżČ·µÄŹĒ
A.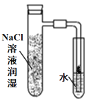 B.
B.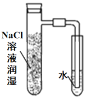 C.
C.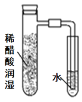 D.
D.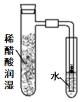
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(1)»š¼ż·¢Éä³£ŅŌŅŗĢ¬ėĀ(N2H4)ĪŖČ¼ĮĻ£¬ŅŗĢ¬¹żŃõ»ÆĒāĪŖÖśČ¼¼Į”£ŅŃÖŖ£ŗ16gŅŗĢ¬ėĀÓėŅŗĢ¬¹żŃõ»ÆĒāĒ”ŗĆĶźČ«·“Ӧɜ³ÉµŖĘųŗĶŅŗĢ¬Ė®Ź±·Å³ö321kJČČĮ棬ŹŌŠ“³öŅŗĢ¬N2H4ŗĶŅŗĢ¬H2O2·“Ó¦µÄČČ»Æѧ·½³ĢŹ½__________”£
(2)ŅŃÖŖ£ŗN2H4(l)£«O2(g)=N2(g)£«2H2O(g)”£ėĀ(N2H4)”ŖæÕĘųČ¼ĮĻµē³ŲŹĒŅ»ÖÖ¼īŠŌČ¼ĮĻµē³Ų£¬µē½āÖŹČÜŅŗŹĒ20%~30%µÄKOHČÜŅŗ”£øƵē³Ų·ÅµēŹ±£¬øŗ¼«µÄµē¼«·“Ó¦Ź½ŹĒ_______”£
(3)½«ÅØ¶Č¾łĪŖ0.10 mol”¤L-1µÄCH3COOHČÜŅŗŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ĖłµĆ»ģŗĻČÜŅŗÖŠø÷ÖÖĄė×ÓÅØ¶Č“óŠ”Ė³Šņ_______________”£
(4)ŅŃÖŖijĪĀ¶ČĻĀ£¬“æĖ®ÖŠµÄc(H+)= 2.0”Į10-7 mol/L”£øĆĪĀ¶ČĻĀ£¬²ā¶ØijĮņĖįČÜŅŗÖŠc(SO42-)=5”Į10-6mol/L£¬øĆĮņĖįČÜŅŗÖŠÓÉĖ®µēĄė³öµÄOH-ÅضČĪŖ_________________”£
(5)ŌŚ25 ”ꏱ£¬ĻņV mL pH£½mµÄHNO3ÖŠµĪ¼ÓpH£½nµÄKOHČÜŅŗ10V mLŹ±£¬ČÜŅŗÖŠn(NO3-)=10 n(K£«)£¬Ōņm£«nµÄÖµĪŖ____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÕņæČŅ©ćåŹęĢ¹æÉÓÉ»ÆŗĻĪļ¼×ŗĶ»ÆŗĻĪļŅŅŌŚŅ»¶ØĢõ¼žĻĀÖĘµĆ£ŗ
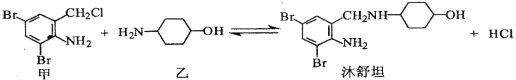
ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ( )
A. ¼×µÄ·Ö×ÓŹ½ĪŖC7H4NBr2Cl
B. ćåŹęĢ¹·Ö×ÓÖŠ×ī¶ąÓŠ13øöĢ¼Ō×Ó¹²Ę½Ćę
C. ŅŅÓöFeCl3ČÜŅŗĻŌ×ĻÉ«
D. ·“Ó¦¹ż³ĢÖŠ¼ÓČėŹŹĮæK2CO3æÉĢįøßćåŹęĢ¹µÄ²śĀŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĄė×Ó·“Ó¦Éę¼°µ½H2O”¢ClO£”¢NH4+”¢OH£”¢N2”¢Cl£µČĪ¢Į££¬ĘäÖŠN2”¢ClO-µÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
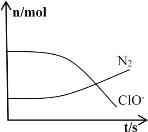
A. øĆ·“Ó¦ÖŠCl£ĪŖŃõ»Æ²śĪļ
B. ĻūŗÄ1mol»¹Ō¼Į£¬×ŖŅĘ6molµē×Ó
C. NH4+±»ClO£Ńõ»Æ³ÉN2
D. ·“Ó¦ŗóČÜŅŗµÄĖįŠŌ¼õČõ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼××éĶ¬Ń§Éč¼ĘµÄŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
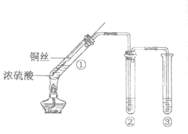
(1)ŹŌ¹Ü¢ŁÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ____________ ”£
(2)ŹŌ¹Ü¢ŚÖŠµÄĘ·ŗģČÜŅŗĶŹÉ«”£ÓūÖ¤Ć÷Ę·ŗģĶŹÉ«µÄŌŅņŹĒSO2£¬ŠčŅŖ²¹³äµÄŹµŃé²Ł×÷¼°Ó¦³öĻֵďµŃéĻÖĻóŹĒ____________”£
(3)ŹŌ¹Ü¢ŪÖŠµÄŹŌ¼ĮŹĒNaOHČÜŅŗ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ____________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com