
| 序号 | 温度 | 0.1mol•L-1Na2S2O3溶液 | 0.1mol•L-1H2SO4溶液 | H2O | 达到相同程度所用的时间/s |
| ① | 25℃ | 25mL | 25mL | 0mL | 4 |
| ② | 25℃ | 25mL | 15mL | 10.0mL | 6 |
| ③ | 25℃ | V1 | 25mL | 10mL | 6 |
| ④ | 45℃ | V2 | 25mL | V3 | 2 |
分析 (1)量取液体需要用量筒,根据溶液的体积选择量筒的规格;
(2)根据物质的性质特点确定,硫单质为固体,可称其质量;
(3)讨论单一变量对反应速率的影响,根据变量单一分析;
(4)讨论温度对反应速率的影响,其它量必须一致,根据四个试验序号的量的关系分析解答;
(5)溶液变澄清,说明硫单质与氢氧化钠参加了反应.
解答 解:(1)量取液体需要用量筒,根据溶液的体积选择量筒的规格,Na2S2O3溶液、H2SO4溶液、水三者的体积之和为50mL,故答案为:量筒,50mL;
(2)反应产生了硫酸钠、二氧化硫、硫单质,根据物质的性质,可选择硫单质的量比较简单,故选C;
(3)实验①、②的硫酸浓度不同,故可探究浓度对反应速率的影响;①、③加入的硫代硫酸钠的浓度的量不同,故可探究浓度对反应速率的影响,而要探究温度对反应速率的影响,则必须保持其他影响因素一致:即溶液体积之和为50毫升,硫酸相同,算出加入的Na2S2O3溶液的量,故V1=15.0mL,故答案为:相同温度下,反应物浓度越大,反应速率越快;15;
(4)实验④时研究温度对化学反应速度的影响,只能与③作对比试验,Na2S2O3溶液、H2SO4溶液、水三者的量必须相同,故答案为:15;10;
(5)小组向废液中加入少量的NaOH溶液至溶液呈微酸性,发现溶液变澄清,故硫单质与氢氧化钠反应了,反应方程式为:6NaOH+3S=2Na2S+Na2SO3+3H2O,
故答案为:6NaOH+3S=2Na2S+Na2SO3+3H2O.
点评 本题考查对影响反应速率的因素的探究实验,应注意的是在探究一个对反应速率的影响因素的时候,应保持其他的影响因素一致.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 同浓度的四种溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4Al(SO4)2溶液,c(NH4+)浓度的大小关系:②>④>③>① | |
| B. | 一定浓度的NaHS溶液中:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 若0.1 mol/L NH4Cl溶液pH=5,则其中离子浓度最大与最小的差值为(0.1-10-5)mol/L | |
| D. | 现有四种溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水 ④pH=10的CH3COONa溶液,其中水电离出的氢离子浓度大小关系为:②=④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
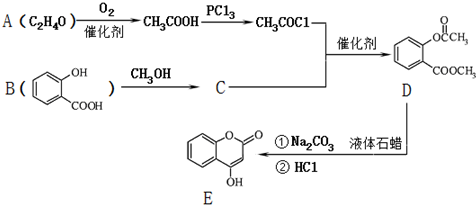
 .
. ;
;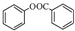 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
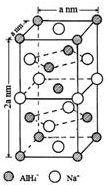 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.  .
.  .
.  (标明配位键).
(标明配位键). 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要完成实验需称取10.6gNa2CO3•10H2O晶体 | |
| B. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线,会导致溶液浓度偏高 | |
| C. | 配制时若容量瓶不干燥,含有少量蒸馏水会导致浓度偏低 | |
| D. | 定容时俯视刻度线会导致浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | V1L④与V2L①混合,若混合后溶液pH=7,则V1<V2 | |
| C. | 分别加水稀释10倍后,四种溶液的pH①>②>④>③ | |
| D. | ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H18O5 | B. | C14H22O3 | C. | C16H26O5 | D. | C16H20O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com