
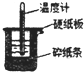
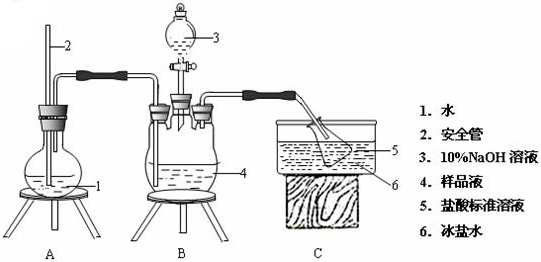
 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据弱电解质电离吸热分析;
(5)不盖硬纸板,会有一部分热量散失.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.05mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用50mL0.50mol•L-1盐酸代替H2SO4溶液进行上述实验,测得中和热数值相等;
故答案为:不相等;相等;
(4)醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替盐酸溶液反应,反应放出的热量偏小;
故答案为:偏小;
(5)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小.
点评 本题考查学生有关中和热的测定原理和仪器,掌握测定的原理是解题的关键,难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
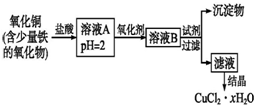 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL量筒量取12.36mL浓硫酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 用500mL的容量瓶配制500mL0.2 mol/L盐酸溶液 | |
| D. | 用广泛pH试纸测得某溶液的pH为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26g乙炔所含共用电子对数目为3NA | |
| B. | 标准状况下,11.2L三氯甲烷所含的分子数为0.5NA | |
| C. | 一定条件下,2.6g乙炔、苯和苯乙烯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1mol甲基含10NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | 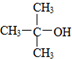 的命名:2,2-二甲基-2-乙醇 的命名:2,2-二甲基-2-乙醇 | |
| C. | 常温下,浓度都为0.1mol•Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者 | |
| D. | 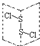 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:
已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com