
���� ��1����������ʽ�����Ӧ���ɵļ״������ʵ���Ũ�ȣ��ٸ���v=$\frac{��c}{��t}$���㣻
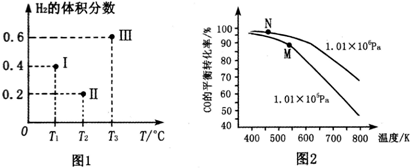
��2���ﵽƽ��״̬ʱ������ת����������������������С�����ݷ�Ӧ�ﷴӦ�����ͷ����������ȼ��㣻
��3���÷�ӦΪ���ȷ�Ӧ���¶�Խ�ͣ���Ӧ����������еij̶�Խ��
��4�������¶ȡ�ѹǿ�Է�Ӧ���ʵ�Ӱ���Լ����豸��Ҫ�������
��5��ȼ�ϵ���У�������ȼ��ʧ���ӷ���������Ӧ��ÿͨ��1mol��������0.5mol������
��� �⣺��1���跴Ӧ���ɵļ״����ʵ���Ϊx��
CO��g��+2H2��g���TCH3OH��g��
��ʼ��mol����1 2 0
ת����mol����x 2x x
ƽ�⣨mol����1-x 2-2x x
��5minʱ���������������Ϊ0.2����$\frac{2-2x}{��1-x��+��2-2x��+x}$=0.2����x=$\frac{7}{8}$��
��v=$\frac{��c}{��t}$=$\frac{\frac{\frac{7}{8}mol}{2L}}{5min}$=0.0875mol/��L•min����
�ʴ�Ϊ��0.0875mol/��L•min����
��2���ﵽƽ��״̬ʱ������ת����������������������С��II��Ӧ�����������������С������II���ܴﵽ��ƽ��״̬��
ƽ��ʱ�����ݣ�1����������ת����Ϊ2x=1.75mol���ų�����20.5kJ����ת��2mol�����ų�����Ϊ23.4kJ�����H=-23.4kJ•mol-1��
�ʴ�Ϊ��II��-23.4kJ•mol-1��
��3����ͼ2��֪�������¶�CO��ת���ʼ�С�������淴Ӧ�ƶ������Ը÷�ӦΪ���ȷ�Ӧ���¶�Խ�ߣ���Ӧ���淽����еij̶�Խ��CO��ת����Խ�ͣ����¶���ͣ�
��ͼ2��֪�������¶�CO��ת���ʼ�С�������淴Ӧ�ƶ������Ը÷�ӦΪ���ȷ�Ӧ���¶�Խ�ͣ���Ӧ����������еij̶�Խ��KԽ����֪I���¶���ͣ�����K���
�ʴ�Ϊ����
��4�������N����ԣ�����M�㣬�¶���500-600K֮�䣬�¶Ƚϸߣ���Ӧ���ʽϿ죬CO��ƽ��ת����Ҳ�ϸߣ�ѹǿΪ��ѹ�����豸Ҫ�ߣ�
�ʴ�Ϊ�������N����ԣ�����M�㣬�¶���500-600K֮�䣬�¶Ƚϸߣ���Ӧ���ʽϿ죬CO��ƽ��ת����Ҳ�ϸߣ�ѹǿΪ��ѹ�����豸Ҫ�ߣ�
��5��������������ȼ�ϼ״�ʧ���ӵ�������Ӧ�������缫��ӦʽΪCH3OH-6e-+3O2-=CO2+2H2O��
��·��ͨ���ĵ���Ϊ$\frac{1.929��1{0}^{4}}{1.602��1{0}^{-19}��6.02��1{0}^{23}}$=0.2mol�������ɱ�״�������������Ϊ2.24L��
�ʴ�Ϊ��CH3OH-6e-+3O2-=CO2+2H2O��2.24��
���� ���⿼���˷�Ӧ�ȵļ��㡢��ѧƽ�������Ӱ�����ء���ѧƽ��ͼ��Ӧ������ƽ�ⳣ�����绯ѧ��Ӧ�õȣ�ע���������ջ�ѧƽ��ļ��㷽�����Ѷ��еȣ������ڿ���ѧ���ķ��������ͼ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2+CuO�TCu+H2O | B�� | 2Na2O2+2H2O�T4NaOH+O2�� | ||
| C�� | H2+Cl2�T2HCl | D�� | 2NaOH+Cl2�TNaCl+NaClO+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 8�� | B�� | 6�� | C�� | 4�� | D�� | 3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪�������ȼ��Ϊ�£�N2H4����������Ϊ�������⣬������ֹ��������ѺϽ���ϣ���ش��������⣺
��֪�������ȼ��Ϊ�£�N2H4����������Ϊ�������⣬������ֹ��������ѺϽ���ϣ���ش��������⣺| ���� | �۵�/K | �е�/K | ˮ���ܽ�ȣ���״���� |
| H2S | 187 | 202 | ÿ��ˮ���ܽ�2.6L |
| H2O2 | 272 | 423 | ������Ȼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
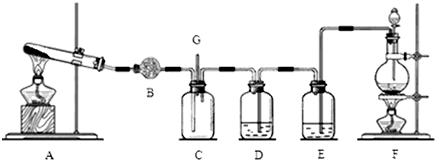
 ij�о���ѧϰС����̽��ԭ��ص��γ�����������ͼ��ʾװ�ý������鲢�õ��±�ʵ������
ij�о���ѧϰС����̽��ԭ��ص��γ�����������ͼ��ʾװ�ý������鲢�õ��±�ʵ������| ��� | A | B | �ձ��е�Һ�� | ����������ָ���Ƿ�ƫת |
| 1 | Zn | Cu | ϡ���� | �� |
| 2 | Zn | Cu | �Ҵ� | �� |
| 3 | Cu | C | �Ȼ�����Һ | �� |
| 4 | Mg | Al | ����������Һ | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�1 L 0.1 mol•L-1 ��NH4NO3��Һ�е�ԭ����Ϊ0.2NA | |
| B�� | ��״���£�2.24 L�����й��ۼ���ĿΪ1.9NA | |
| C�� | �����£�28.0 g��ϩ�Ͷ�ϩ�Ļ�������к��е�̼ԭ����Ϊ2NA | |
| D�� | ����Fe���״����22.4 L Cl2��ַ�Ӧ��ת�Ƶĵ�����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�䣨min�� Ũ�ȣ�mol•L-1�� | 0 | 5 | 10 | 15 | 25 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | a | a | b | b |
| CO2 | 0 | 0.21 | a | a | 0.36 | 0.36 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com