
| A. | Cl2与水反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 将鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 铁与盐酸反应:Fe+2H+═Fe2++H2↑ |
分析 A.反应生成的HClO在离子反应中保留化学式;
B.漏写生成氢氧化铜的离子反应;
C.醋酸在离子反应中保留化学式;
D.反应生成氯化亚铁和氢气.
解答 解:A.Cl2与水反应的离子反应为Cl2+H2O═H++HClO-+Cl-,故A错误;
B.CuSO4溶液中加入Ba(OH)2溶液的离子反应为Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故B错误;
C.将鸡蛋壳在醋酸中溶解有气泡产生的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故C错误;
D.铁与盐酸反应的离子反应为Fe+2H+═Fe2++H2↑,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
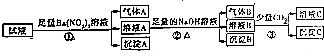
| A. | 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 试液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
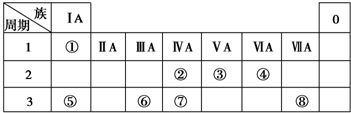
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂. ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素属于第6周期 | |
| B. | 该元素位于IVA族 | |
| C. | 该元素为金属元素,性质与82Pb(铅)相似 | |
| D. | 该元素原子含有114个电子和184个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →
→
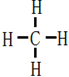 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| B. | 二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5 mL 3%的过氧化氢后产生沉淀 | |
| C. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| D. | 二氧化硫漂白过的草帽过一段时间后变黄 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com