
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
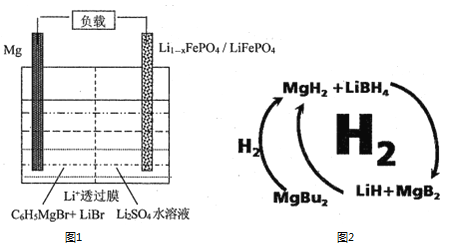
(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为_____(填“正极”或“负极”)。
②充电时,Li+迁移至_____________(填“阳极区”或“阴极区”)。
(2)纳米MgH2和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为_____________________________________________。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =____kJ·mol-1
(4)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
①图中p1、p2、p3、p4代表不同压强,压强最大的是_______。该反应的△H___(填“>”“<”“=”下同)0。
②压强为p4时,在Y点:v(正)__________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为______。
【答案】 负极 阴极区 MgH2+2LiBH4![]() 2LiH+MgB2+4H2↑ -659 p4 > < K4>K3>K2>K1
2LiH+MgB2+4H2↑ -659 p4 > < K4>K3>K2>K1
【解析】(1)由镁—锂双离子二次电池的装置图中的信息可知,Mg是负极,Li1-xFePO4是正极。①放电时,Mg电极为负极。②充电时,阳离子向阴极定向移动,所以 Li+迁移至阴极区。
(2)纳米MgH2和LiBH4组成的体系在400℃以上受热放氢时发生反应的化学方程式为MgH2+2LiBH4![]() 2LiH+MgB2+4H2↑ 。
2LiH+MgB2+4H2↑ 。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:①2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1;②2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1。根据盖斯定律,由①-②得,2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =-659kJ·mol-1。
(4)在一定条件下,反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g),平衡时CH4的转化率与温度和压强的关系如图3所示。
①该反应是一个气体分子数增多的反应,在相同温度下, CH4的平衡转化率随压强的增大而减小,所以压强最大的是p4。由图可知,在相同压强下,CH4的平衡转化率随温度的升高而增大,所以该反应为吸热反应,该反应的△H >0。
②由图可知,压强为p4时,在Y点的转化率高于其平衡转化率,所以该反应正在向逆反应方向进行,v(正) <v(逆)。
③由于该反应为吸热反应,所以该反应的平衡常数K随温度升高而增大 ,因此,图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为K4>K3>K2>K1。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】常温下能大量共存的无色透明离子组是( )
A.K+、Na+、NO3-、MnO4-B.NH4+、CH3COO-、Ca2+、Cl-
C.OH-、Na+、Br-、HCO3-D.H+、Ba2+、Fe2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质变化的化学用语正确的是
A. NH3·H2O的电离方程式:NH3·H2O==NH4++OH-
B. 铁发生吸氧腐蚀的正极反应方程式:O2+2H2O+4e-==4OH-
C. 碳酸钠水解的离子方程式:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
D. CO燃烧热的热化学方程式:2CO(g)+O2(g)=2CO2(g) △H =-566.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl.
(1)上述物质中属于电解质的有__________(填序号)。
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是________________________。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH﹣═H2O,则该反应的化学方程式为______________________________。
(4)⑦的浓溶液与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O。
①该反应中的氧化剂是________,氧化产物是_________。
②浓盐酸在反应中显示出来的性质是____________。
③产生0.1mol Cl2,被氧化的的浓盐酸的物质的量为_______mol。
II(1)写出铁与水蒸气在高温下反应方程式___________________________。
(2)常温下,铜在潮湿的空气里会被锈蚀,有关化学方程式为_________________________________。
(3)在呼吸面具中,Na2O2 与CO2反应的化学方程式为____________________________________。当有7.8克Na2O2反应时,放出氧气的质量为____________。
(4)将铜片投到FeCl3溶液中,发生的反应离子方程式为__________________________。
(5)向FeSO4溶液中滴加NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出此变化过程的化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式____________。
(2)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:___________。
(3)许多+l价铜的配合物溶液能吸收CO和烯烃(如C2H4等), CH3CH= CH 2 分子中3个C原子采取的杂化方式依次为___________。
(4)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后沉淀完全溶解。写出此蓝色沉淀溶解的离子方程式:_____________;
(5)B的氢化物比氨气的熔沸点略高,请解释原因:_____________;
(6)1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2。
据上所述,可推知C60分子有12个五边形和20个六边形。

请回答下列问题:
1)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)__________,并简述其理由:_______________。
2)C70和C60结构类似,则分子中含有______个六边形和______个五边形。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质: ①Cu ②SO2③冰醋酸④NaHCO3⑤Cu(OH )2⑥ H2SO4溶液⑦NaCl,属于非电解质的是____________(填序号),属于强电解质的是_______(填序号)。
(2)写出NaHCO3水解的离子方程式:______________________。
(3)已知Ksp[Cu(OH)2]=2×10-20,常温下某CuSO4溶液里,c(Cu2+)=2.0 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于_______。
(4)现有25℃、pH=1的H2SO4溶液,该溶液的物质的量浓度为______,溶液中由水电离出的c(OH-)=_____。
(5)电解饱和食盐水溶液时,电极上生成了气体A 和B,气体B是____(填化学式);从阴极析出1.42L气体A,从阳极析出________L气体B(在标准状况下)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的树状分类和交叉分类,HNO3属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥一元酸 ⑦化合物 ⑧混合物
A.①②③④⑤⑥⑦
B.①④⑥⑦
C.①⑧
D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )

A. 正极反应式为![]()
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池负极增重9.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com