


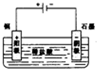
 解:(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化,离子方程式为:Cu+H2O2+2HCl=CuCl2+2H2O,用电解原理实现铜和盐酸的反应,根据电解原理阳极必须是金属铜,电解质必须是稀盐酸,故答案为:Cu+H2O2+2HCl=CuCl2+2H2O;
解:(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化,离子方程式为:Cu+H2O2+2HCl=CuCl2+2H2O,用电解原理实现铜和盐酸的反应,根据电解原理阳极必须是金属铜,电解质必须是稀盐酸,故答案为:Cu+H2O2+2HCl=CuCl2+2H2O;

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com