
| A. | 普通硬质玻璃 | B. | 铅玻璃 | C. | 钢化玻璃 | D. | 玻璃钢 |
分析 A.硬质玻璃具有耐高温、高压、耐腐蚀、机械强度高、耐温差变化,多用于制造烧杯,烧瓶,压力管及成套实验装置;
B.铅玻璃中含有氧化铅,用于制造光学玻璃、电真空玻璃、低温封接玻璃、防辐射玻璃、铅晶质玻璃、火石类光学玻璃、低熔玻璃、延迟线玻璃、高折射微珠玻璃及艺术器皿玻璃等;
C.钢化玻璃,属于安全玻璃,当玻璃受外力破坏时,碎片会成类似蜂窝状的钝角碎小颗粒,不易对人体造成严重的伤害;
D.玻璃管硬度大,可以代替钢材制造机器零件和汽车、船舶外壳.
解答 解:A.硬质玻璃多用于制造烧杯、烧瓶等,不适合于火车、汽车车窗玻璃,故A错误;
B.铅玻璃是一种含有氧化铅玻璃,具有防辐射功能,不适用于火车、汽车的车窗,故B错误;
C.钢化玻璃是将普通退火玻璃先切割成要求尺寸,然后加热到接近软化点的700度左右,再进行快速均匀的冷却而得到;可以阻挡阳光中的大部分热能和紫外线,能透过高达80%以上的可见光,反射的可见光却很少,当玻璃受外力破坏时,碎片会成类似蜂窝状的钝角碎小颗粒,不易对人体造成严重的伤害,常用于汽车或火车窗玻璃,故C正确;
D.玻璃钢具有较大硬度,可替钢材制造机器零件和汽车、船舶外壳,不适用于汽车、火车的车窗玻璃,故D错误;
故选C.
点评 本题主要考查了不同玻璃的特性和用途,题目难度中等,解题的关键是掌握不同玻璃的有关特征以及相应用途,平时注意生活化学知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | ②①④③⑤ | B. | ②③④①⑤ | C. | ②③⑤④① | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉-碘化钾溶液和溴水 | B. | 氢氧化钠溶液与碘水 | ||
| C. | 新制Cu(OH)2悬浊液与碘水 | D. | 碘化钾溶液与碘水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过二硫酸钾的化学式为K2S2O8,其中硫元素为+6价 | |
| B. | KMnO4和K2MnO4中原子团组成相同,其化学性质相同 | |
| C. | 有机物的分子式、结构简式、实验式都不相同 | |
| D. | 摩尔质量相同的物质,其化学式一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: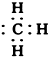 | |
| C. | 乙醇的最简式:C2H6O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{111}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有反应:A、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
现有反应:A、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com