
【题目】下列各组化合物中,化学键类型完全相同的是:( )
A. HCl 和NaOHB. Na2O 和Na2O2
C. CO2和 CaOD. CaCl2和 Na2S
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)根据分子中所含官能团可预测有机化合物的性质. ①下列化合物中能发生消去反应的是(填字母).
a.CH3OH b.CH3CH2Cl c.CH3CH2OH d. ![]()
②下列化合物中,常温下易被空气氧化的是(填字母).![]()
③为检验C3H7Br中溴元素进行如下操作:①加热煮沸;②加入AgNO3溶液;③取少量该卤代烃;④加入足量稀硝酸酸化;⑤加入NaOH溶液;⑥冷却.正确的操作顺序是③⑤①⑥ .
(2)化合物C是一种医药中间体,可通过下列方法合成: ![]()
![]() [B]
[B] ![]()
已知: ![]()
![]()
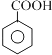
①C中含氧官能团的名称为醚键和 . ②B的结构简式为 .
③B→C的反应类型为 .
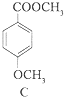
(3)生活中常用的某种香料X的结构简式为: 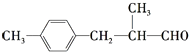 ①香料X中含氧官能团的名称是 .
①香料X中含氧官能团的名称是 .
②香料X可发生的反应类型是(填代号)
a.酯化反应b.还原反应 c.加成反应d.消去反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W元素在周期表中的位置
(2)X、Y、Z、W分别形成的简单离子的半径由小到大的顺序为<<<(用化学式填写,下同);Y、Z对应的气态氢化物的稳定性> .
(3)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 .
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2 , 该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去). 
已知:①2NO+Na2O2═2NaNO2;
②NO能被酸性KMnO4氧化成NO3﹣ , MnO4﹣被还原为Mn2+ .
(1)制备NaNO2
(i)装置A三颈烧瓶中发生反应的化学方程式为 .
(ii)B装置的目的是 .
(iii)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是(填序号).
A.P2O5 B.碱石灰 C.无水CaCl2 D.生石灰
(iv)E装置发生反应的离子方程式是 .
(2)测定NaNO2纯度
准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解.用a molL﹣1酸性KMnO4溶液滴定,达滴定终点时所用KMnO4溶液体积为bml.则样品中NaNO2的质量分数为 .
(假设样品中其他杂质与酸性KMnO4溶液不反应,用含m、a、b的代数式表示.)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)Z(g)+W(s)△H>0,下列叙述正确的是( )
A.在容器中加入氩气,反应速率不变
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.若将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.b点对应的溶液中:H+、Fe3+、MnO4-、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:S2-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用浓海水提镁的一段工艺流程如下图:
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是 . 在上述流程中,可以循环使用的物质是 .
(2)在该工艺过程中,X试剂的化学式为 .
(3)“一段脱水”目的是制备MgCl22H2O;“二段脱水”的目的是制备电解原料.若将MgCl26H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为 .
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为g.
(5)以LiCl﹣KCl共熔盐为电解质的Mg﹣V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 该电池的正极反应式为 .
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则: Mg(s)+2B(s) MgB2(s)△H= . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com