
(14分)煤粉中的氮元素在使用过程中的转化关系如下图所示:
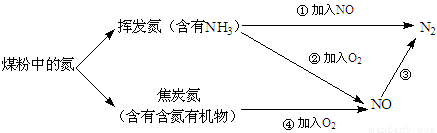
(1)②中NH3参与反应的化学方程式为 。
(2)③中加入的物质可以是 (填字母序号)。
a.空气 b.CO c.KNO3 d.NH3
(3)焦炭氮中有一种常见的含氮有机物吡啶(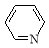 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
),其分子中相邻的C和N原子相比,N原子吸引电子能力更 (填“强”或“弱”),从原子结构角度解释原因: 。
(4)已知:N2(g) + O2(g)===2NO(g) ΔH = a kJ·mol-1
N2(g) + 3H2(g)===2NH3(g) ΔH = b kJ·mol-1
2H2(g) + O2(g)===2H2O(l) ΔH = c kJ·mol-1
反应后恢复至常温常压,①中NH3参与反应的热化学方程式为 。
(5)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
科目:高中化学 来源:2014-2015福建省四地六校高二下学期第一次联考化学试卷(解析版) 题型:选择题
共价键是有饱和性和方向性的,下列有关叙述不正确的是
A、共价键的饱和性是由成键原子的未成对电子数决定的
B、共价键的方向性是由成键原子的轨道的方向性决定的
C、共价键的饱和性决定了分子内部的原子的数量关系
D、共价键的饱和性与原子轨道的重叠程度有关
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省高一3月月考化学试卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数,下列说法正确的是
A.在标准状况下,NA个水分子所占的体积约为22.4L
B.5.6g铁与氯气完全反应,失去电子的数目为0.2NA
C.1 mol C12发生化学反应,转移的电子数必为2NA
D.在标准状况下,22.4L由N2、N2O组成的混合气体中所含有的N的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
下列结论正确的是
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.②⑤⑦ B.②④⑥
C.②④⑤⑥⑦ D.②⑥⑦
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一4月月考化学试卷(解析版) 题型:选择题
关于元素周期表和元素周期律的应用有如下叙述:
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料。
其中正确的是
A.①②③④ B.②③④
C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三一模理综化学试卷(解析版) 题型:选择题
下列选项中的反应、现象与结论完全一致的是(夹持、加热装置已略去)
①中的反应 | ②中的现象 | 结论 | |
A | MnO2与浓盐酸加热 | KI淀粉溶液很快变蓝 | Cl2有氧化性 |
B | Cu与浓硫酸加热 | 溴水褪色 | SO2有漂白性 |
C | Na2CO3与醋酸溶液 | 苯酚钠溶液变浑浊 | 酸性:碳酸>苯酚 |
D | 电石与饱和食盐水 | 酸性高锰酸钾溶液褪色 | 乙炔有还原性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东湛江高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
液氨是一种良好的储氢物质。
已知:①2NH3(g)  N2 (g)+3H2(g) ΔH = +92.4 kJ·mol-1
N2 (g)+3H2(g) ΔH = +92.4 kJ·mol-1
②液氨中2NH3(l)  NH2- +NH4+
NH2- +NH4+
(1)氨气自发分解的反应条件是 (填“低温”或“高温”)。
(2)图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。反应的活化能最大的是 (填催化剂的化学式)。
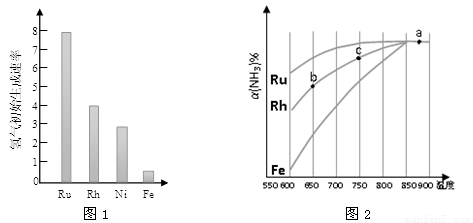
(3)其他条件相同,反应①在不同催化剂作用下反应相同时间后,氨气的转化率随反应温度的变化如图2所示。
①a点所代表的状态________(填“是”或“不是”)平衡状态。
②c点氨气的转化率高于b点,原因是 。
③请在图2中再添加一条Ni催化分解氨气过程的总趋势曲线。
④假设Ru催化下,温度为750 ℃时,氨气的初始浓度为c0,平衡转化率为40%,则该温度下此反应的平衡常数K = 。
(4)用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
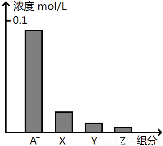
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第二次模拟理综化学试卷(解析版) 题型:简答题
(14分)高纯硅晶体是信息技术的重要材料。
(1)在周期表的以下区域中可以找到类似硅的半导体材料的是______(填字母)。
A.过渡元素区域 B.金属和非金属元素的分界线附近
(2)工业上用石英和焦炭可以制得粗硅。已知:
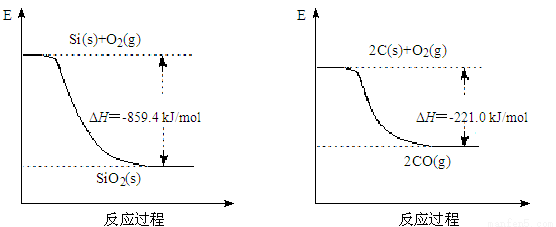
写出用石英和焦炭制取粗硅的热化学方程式 ______。
(3)某同学设计下列流程制备高纯硅:
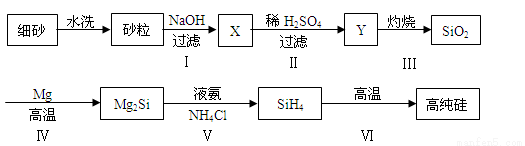
①Y的化学式为______。
②写出反应Ⅰ的离子方程式 。
③写出反应Ⅳ的化学方程式 。
④步骤Ⅵ中硅烷(SiH4)分解生成高纯硅,已知甲烷分解的温度远远高于硅烷,用原子结构解释其原因是 。
(4)将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应:
SiHCl3 (g) + H2(g)  Si(s) + 3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是 (填字母)。
Si(s) + 3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是 (填字母)。
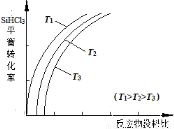
A.该反应是放热反应
B.横坐标表示的投料比应该是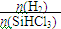
C.该反应的平衡常数随温度升高而增大
D.实际生产中为提高SiHCl3的利用率,可以适当增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com