
【题目】生活中处处有化学。请回答下列问题
(1)苏打水是很多人喜爱的饮品,请写出小苏打在水中的电离方程式__________
(2)“84消毒液”与洁厕灵(主要成分是浓盐酸)不能混用,混合会产生黄绿色的有毒气体,请用离子反应方程式解释原因____________
(3)咖啡中含有咖啡因(C8H10N4O2),咖啡因可以使我们的神经兴奋,若一杯咖啡中含有0.194g咖啡因,则这杯咖啡中有______________个咖啡因分子。
【答案】NaHCO3 = Na+ + HCO3- ClO - + Cl- + 2H+ = Cl2↑+ H2O 6.02×1020 (或 1×10-3NA )
【解析】
根据电离方程式的书写规则、离子反应方程式的书写规则、物质的量的相关计算分析解答。
(1) 小苏打是NaHCO3,小苏打在水中的电离方程式是:NaHCO3=Na++HCO3-,
故答案为:NaHCO3=Na++HCO3-;
(2) 84消毒液主要成分是NaClO,洁厕灵主要成分是HCl,“84消毒液”与洁厕灵(主要成分是浓盐酸)混用反应生成氯气,离子反应方程式是:ClO - + Cl- + 2H+ = Cl2↑+ H2O,
故答案为:ClO - + Cl- + 2H+ = Cl2↑+ H2O;
(3)n(C8H10N4O2)=![]() =0.001mol,则这杯咖啡中有0.001NA个咖啡因分子,
=0.001mol,则这杯咖啡中有0.001NA个咖啡因分子,
故答案为:6.02×1020 (或 1×10-3NA )。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液。己知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2PbSO4(s)+2H2O(l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )

A. d极为阴极
B. 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(l)
C. 若利用甲池精炼铜,b极应为粗铜
D. 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.76 g铜镁合金完全溶解于50 mL、密度为1. 40 g cm-3、质量分数为63%的浓硝酸中,得到NO2气体1 792 mL(标准状况),向反应后的溶液中加入适量的1.0 mol L-1的NaOH 溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 该浓硝酸中的HNO3的物质的量浓度是14.0 mol L-1
B. 加入NaOH溶液的体积是50 mL
C. 浓硝酸在与合金的反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08 mol
D. 得到的金属氢氧化物的沉淀为3.12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是自然赐给人类的宝藏,海水的综合利用是全世界研究的重点。完成下列问题:
(1)粗盐中除了含有泥沙之外还含有Ca2+、Mg2+、SO42-等杂质,粗盐获得精盐一般步骤如下:

加入的试剂①、②分别是:_________、_________。
(2)某学生在实验室中模拟海水提取溴的步骤为:
取25 L除去悬浮杂质后的海水,浓缩至2L,向其中通入足量氯气。
① 氧化步骤中生成Br2的离子方程式为_______________________________。
② 将吹出的Br2(g)用纯碱溶液全部吸收,发生反应:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑ ,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀。计算海水中溴的浓度为_______g/L。
③实验室中若用CCl4提取少量的溴:向溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液,该分离提纯溴的方法叫________;用到的主要仪器为_____________。
(3)实验证明金属制品在海水中更容易生锈,铜锈的化学式为: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是()
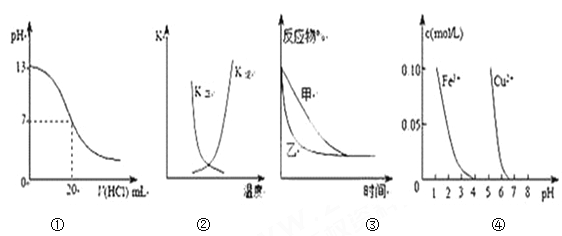
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2A(g) + B(g)![]() 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
C. 图③表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙压强比甲压强大
3C(g)+D(s)的影响,乙压强比甲压强大
D. 据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O=CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是_______(用元素符号填写)。
(2)氧和硫属于同族元素,写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________________________________。
(3)NaOH的电子式为______________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式______________。
(5)钠一钙联合处理法的优点有________________。(任写一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2A(g)+B(g)![]() 3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
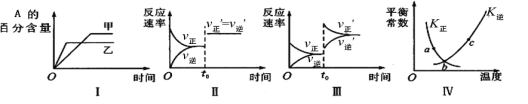
A.图I表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻缩小容器体积对反应速率的影响
C.图Ⅲ表示t0时刻增大B浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
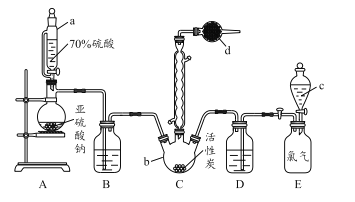
已知:
①SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ/mol
SO2Cl2(l) △H=-97.3 kJ/mol
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是_____________________。
(2)仪器d中盛放的试剂为______。
A.无水硫酸铜 B.无水氯化钙 C.碱石灰 D.五氧化二磷
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为 ___________________。
(4) 装置E为储气装置,用于提供氯气,则分液漏斗c中盛放的试剂为_________。当装置E中排出氯气0.224 L(已折算成标准状况)时,最终得到1.08 g纯净的硫酰氯,则硫酰氯的产率为_____。
(5)长期存放的硫酰氯会发黄,其原因可能为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com