
| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
分析 向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,消耗水,溶液c(Ca2+)、c(OH-)增大,由于原溶液已达到饱和,则平衡向逆反应方向移动,以此解答该题.
解答 解:向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,
A.加入CaO,消耗水,由于原溶液已达到饱和,则平衡向逆反应方向移动,溶液中Ca2+数目减少,故A错误;
B.反应后仍为饱和溶液,c(Ca2+)不变,故B错误;
C.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故C错误;
D.反应后仍为饱和溶液,c(OH-)不变,溶液pH不变,故D正确.
故选D.
点评 本题考查难溶电解质的溶解平衡,题目难度中等,本题注意向悬浊液中加少量生石灰,发生:CaO+H2O=Ca(OH)2,从平衡移动的角度分析.


科目:高中化学 来源: 题型:解答题
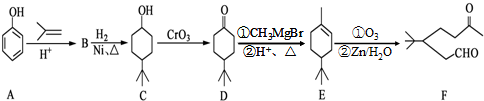
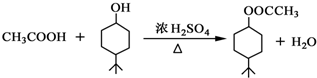 .
.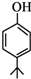 .同时满足下列条件的B的同分异构体(不包括B)共有11种:
.同时满足下列条件的B的同分异构体(不包括B)共有11种: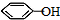 )和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线
)和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线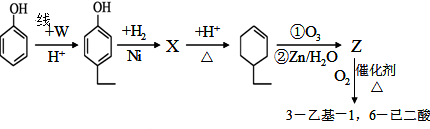
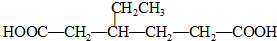
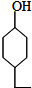 ,Z:
,Z: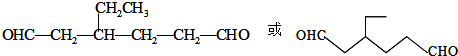 ;
;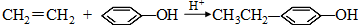 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-| 实验 序号 | 电极 (X) | NaCI溶液浓度 (mol/L) | 甲中石墨表面通人气体 | 电流计读数 (A) |
| (1) | Fe | O.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2vB=3vA | B. | 3vC=2vB | C. | vB=vA | D. | vC=2vB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R元素的氢化物常温下可能为液态 | |
| B. | R一定是第ⅣA族元素 | |
| C. | R的气态氢化物化学式为H2R | |
| D. | R元素的气态氢化物比同周期其他元素的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
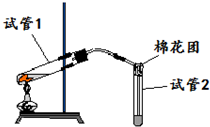 如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
如图是实验室用铜片与浓硫酸反应制取SO2,并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com