
| A.常温下,向含AgCl固体的AgCl溶液中加入NaCl固体,AgCl沉淀的量不变 |
| B.滴定终点时,溶液中CrO42-的浓度约为3.6×10-3 mol·L-1 |
| C.向10mL0.1moL/L AgNO3溶液中滴加3—5滴0.1moL/L NaCl溶液生成AgCl沉淀,再滴加KI溶液,生成AgI沉淀,能够说明Ksp(AgI)< Ksp(AgCl) |
| D.可用0.1 mol·L-1的KI溶液代替K2CrO4做指示剂 |
科目:高中化学 来源:不详 题型:单选题
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.在一定温度下AgCl的水溶液中,Ag+和Cl-物质的量浓度的乘积是一个常数 |
C.25oC时Ksp(AgCl)=l.8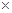 10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI 10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI |
| D.温度一定时,当溶液中Ag+和Cl-物质的量浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ksp越大说明电解质的溶解度越大 |
| B.Ksp只与电解质的本性有关,而与外界条件无关 |
| C.Ksp表示难溶强电解质在水中达到沉淀溶解平衡时,溶液中离子浓度幂之积 |
| D.Ksp的数值只与难溶电解质的性质有关,和温度无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.难溶电解质的溶度积越小,溶解度越大 | B.可以通过沉淀反应使杂质离子浓度为0 |
| C.难溶电解质的溶解平衡是一种静态平衡 | D.一定浓度的NH4Cl溶液可以溶解Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 PbCO3(s)+SO42—(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
PbCO3(s)+SO42—(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,…… | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ca2+(aq)+2OH(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是( )
Ca2+(aq)+2OH(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是( )| A.溶液中Ca2+数目减少 | B.溶液中c(Ca2+)增大[ |
| C.溶液中pH增大 | D.溶液中溶质的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com