
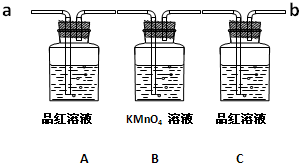


科目:高中化学 来源: 题型:
| A、6.0g/mol |
| B、5.0g/mol |
| C、10.0g/mol |
| D、4.0g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
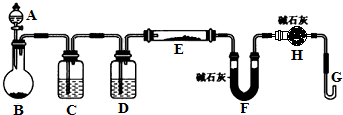 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:| ①空E管的质量a; | ④反应前F管及内盛物的总质量d; |
| ②E管和WO3的总质量b; | ⑤反应后F管及内盛物的总质量e |
| ③反应后E管和W粉的总质量c(冷却后); |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 反应 温度/℃ | c(HCl)/ mol?L-1 | V(HCl) /mL | 10g碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
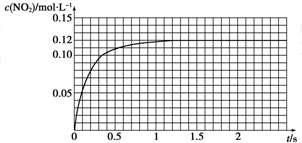
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
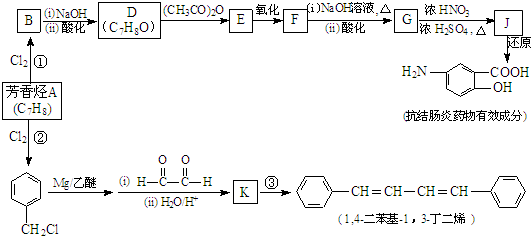
| ||
| (i)R′CHO |
| (ii)H2O/H+ |
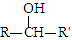 (R、R′表示烃基)
(R、R′表示烃基)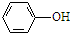
| (CH3CO)2O |
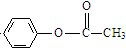
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:1 | B、2:l |
| C、1:1 | D、缺少条件,无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com