
| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 1.50 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 19.85 | 20.22 | 19.98 |
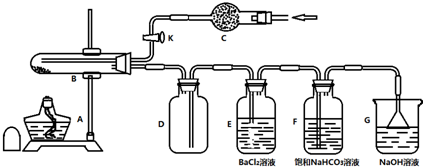
分析 在潮湿空气中易氧化成难溶于水的棕黄色碱式硫酸铁Fe(OH)SO4,装置分析实验过程:
①检查装置的气密性;
②称取2.78g样品,置于B试管中;
③打开活塞K,从C处通入某种气体应是惰性气体赶出装置中的空气,避免空气中氧气干扰产物检验;
④关闭K,对试管B充分加热使FeSO4•7H2O分解;
⑤打开活塞K,从C处再通入惰性气体使生成的气体全部赶到后续装置中检验吸收;
装置分析在B中加热分解硫酸亚铁晶体,D装置避免倒吸起到安全瓶的作用,生成的气体铜鼓装置E检验是否有三氧化硫气体生成,通过装置F中碳酸氢钠溶液检验吸收生成二氧化硫气体,F中生成亚硫酸钠,最后剩余气体需要氢氧化钠溶液吸收防止污染空气,
(1)E中生成沉淀说明是生成硫酸钡沉淀,证明硫酸亚铁晶体分解产物中生成了三氧化硫;
(2)步骤③中从C处通入的气体作用为开始是排净装置中空气,最后是把生成气体全部赶到后面的装置吸收检验;气体不能干扰气体的检验,所以是氮气,不通入生成的二氧化硫气体、氧气在氯化钡溶液中会反应生成硫酸钡沉淀;
(3)甲同学将F中反应后溶液共100mL取出,用0.020mol•L-1的酸性KMnO4溶液进行滴定,高锰酸钾溶液具有强氧化性,能氧化橡胶管,需要盛装在酸式滴定管,滴定过程中发生的反应是高锰酸钾氧化亚硫酸钠生成硫酸钠、硫酸锰和水,分析图表中的数据可知,第一次测定结果误差大舍去,依据第二次和第三次测定结果计算平均消耗高锰酸钾溶液体积,结合化学方程式计算生成二氧化硫物质的量,利用氧化还原反应电子守恒计算铁元素化合价变化的价态判断生成固体成分;
(4)设计实验证明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解,需要避免铁离子的干扰,晶体溶解形成的溶液中先加入铁粉,防止亚铁离子被氧化,滴入石蕊试液变红色,加热溶液红色变深证明是亚铁离子发生水解溶液显酸性.
解答 解:在潮湿空气中易氧化成难溶于水的棕黄色碱式硫酸铁Fe(OH)SO4,装置分析实验过程,故答案为:Fe(OH)SO4:
装置分析在B中加热分解硫酸亚铁晶体,D装置避免倒吸起到安全瓶的作用,生成的气体铜鼓装置E检验是否有三氧化硫气体生成,通过装置F中碳酸氢钠溶液检验吸收生成二氧化硫气体,F中生成亚硫酸钠,最后剩余气体需要氢氧化钠溶液吸收防止污染空气,
(1)E中生成沉淀说明是生成硫酸钡沉淀,证明硫酸亚铁晶体分解产物中生成了三氧化硫,SO3+H2O+BaCl2=BaSO4↓+2HCl
故答案为:SO3;
(2)步骤③中从C处通入的气体作用为开始是排净装置中空气,最后是把生成气体全部赶到后面的装置吸收检验,步骤③中从C处通入的气体作用为将装置中的空气全部赶出,并将FeSO4•7H2O的分解产物全部排出,通入的气体不能干扰气体的检验,选项中A.SO2 B.Cl2 D.NH3,都会干扰产物的验证,选C.N2,所以是氮气,不通入E中发生的副反应为,生成的二氧化硫气体、氧气在氯化钡溶液中会反应生成硫酸钡沉淀,化学方程式为:2SO2+O2+2BaCl2+2H2O=2BaSO4↓+4HCl,
故答案为;将装置中的空气全部赶出,并将FeSO4•7H2O的分解产物全部排出;C;2SO2+O2+2BaCl2+2H2O=2BaSO4↓+4HCl;
(3)高锰酸钾溶液具有强氧化性,能氧化橡胶管,需要盛装在酸式滴定管,滴定过程中发生的反应是高锰酸钾氧化亚硫酸钠生成硫酸钠、硫酸锰和水,反应的离子方程式为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,分析图表中的数据可知,第一次测定结果误差大舍去,依据第二次和第三次测定结果计算平均消耗高锰酸钾溶液体积=$\frac{20.02+10.98}{2}$ml=20.00ml,结合化学方程式计算生成二氧化硫物质的量,
2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,SO2+2NaHCO3=Na2SO3+2CO2+H2O,
5SO2~5SO32-~2MnO4-,
5 2
n 0.0200L×0.020mol•L-1
n=0.001mol
100ml溶液中二氧化硫物质的量=0.1mol,FeSO4~SO2~2e-,2Fe2+~2Fe3+~2e-,所以电子守恒得到固体B为Fe2O3,
故答案为:酸式; 2 MnO4-+5SO32-+6H+=2Mn2++5 SO42-+3H2O; Fe2O3;
(4)设计实验证明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解,需要避免铁离子的干扰,晶体溶解形成的溶液中先加入铁粉,防止亚铁离子被氧化,滴入石蕊试液变红色,加热溶液红色变深证明是亚铁离子发生水解溶液显酸性,实验步骤为:取少量FeSO4•7H2O水溶液于试管中,先加Fe粉,再滴入几滴石蕊试液,试管中溶液微红,然后加热试管中的溶液,若溶液红色加深,则说明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解,
故答案为:取少量FeSO4•7H2O水溶液于试管中,先加Fe粉,再滴入几滴石蕊试液,试管中溶液微红,然后加热试管中的溶液,若溶液红色加深,则说明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解;
点评 本题考查了物质组成的实验探究方法、过程分析判断、滴定实验的注意问题,主要是物质性质的理解应用,掌握基础是解题关键,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
三个密闭容器中分别充入H2、O2、CO2三种气体,以下各种情况下排序正确的是( )
A.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(O2)>m(CO2)
B.当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(02)>ρ(C02)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(CO2)>V(O2)>V(H2)
D.当它们的温度和密度都相同时,三种气体的压强:P(H2)>P(O2)>P(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
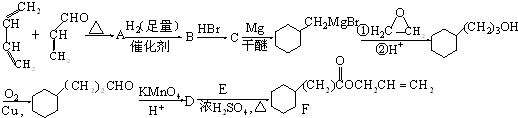
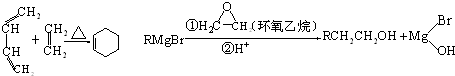
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成BA3化合物 | |
| B. | C、D、E形成的化合物与稀硫酸可能发生氧化还原反应 | |
| C. | A、B、C形成的化合物一定不能发生水解 | |
| D. | E的氧化物一定有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
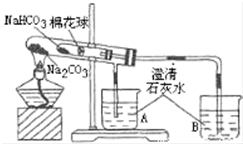 某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写的实验报告的一部分.
某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写的实验报告的一部分. | 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0gNa2CO3固体和NaHCO3固体,观察外观. | / |
| ② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象. | / |
| ③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象. | 溶液变红 |
| ④ | 加热大试管一段时间.(注:棉花球沾有无水硫酸铜粉末) | 有无水硫酸铜粉末的棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极:Zn-2e-═Zn2+(氧化反应) | B. | 正极:O2+2H2O+4e-═4OH-(还原反应) | ||
| C. | 电流流向:Cu→Zn | D. | 正极:2H++2e-═H2↑(还原反应) |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是 。
(2)B、C、D元素的第一电离能由大到小的顺序是 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是 ;B、C的这些氢化物的沸点相差较大的主要原因是 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是 ;1 mol该分子中含有π键的数目是 。
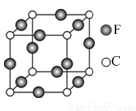
(5)C、E两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu是氧化剂 | B. | H2SO4在反应中只表现氧化性 | ||
| C. | Cu在反应中被氧化 | D. | 1mol氧化剂在反应中得到1mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com