
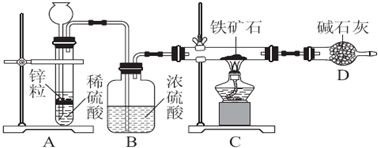
分析 【提出假设】依据假设1、2分析推断假设3为铁矿石中含+2、+3价铁;
【定性研究】(1)样品溶解需要酸,硝酸具有氧化性可能也会亚铁离子,浓盐酸会被高锰酸钾溶液也会生成氯气,所以只有稀硫酸符合;依据实验步骤②加入高锰酸钾溶液褪色证明含有亚铁离子;
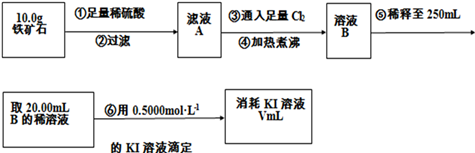
【定量研究】
(2)分析装置图,最后碱石灰可以吸收空气中的水蒸气和二氧化碳导致测定结果偏高,需连接盛碱石灰的干燥管;去掉装置B水蒸气金融业装置D导致测定结果偏高;
(3)依据装置D中水的质量,结合氧元素守恒计算含氧元素质量,得到铁矿石中氧的百分含量;
(4)根据稀释液体和配制一定体积的溶液的步骤所选择的仪器来回答主要是计算、量取、溶解、转移、洗涤转移、定容、摇匀等;
(5)煮沸可以将水中的气体赶走;
(6)根据元素守恒和化学反应方程式进行计算,根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI).
解答 解:【提出假设】假设1:铁矿石中只含+3价铁;假设2:铁矿石中只含+2价铁;依据假设1、2,结合铁元素存在的化合价,分析推断假设3为铁矿石中含+2、+3价铁,
故答案为:铁矿石中含+2、+3价铁;
【定性研究】(1)样品溶解需要酸,硝酸具有氧化性可能也会亚铁离子,浓盐酸会被高锰酸钾溶液也会生成氯气,所以只有稀硫酸符合;依据实验步骤②,向第二份溶液中滴加适量高锰酸钾溶液具有强氧化性,加入高锰酸钾溶液褪色证明被还原,证明含有亚铁离子,
故答案为:稀硫酸;②;
【定量研究】
(2)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,分析装置图,最后碱石灰可以吸收空气中的水蒸气和二氧化碳导致测定结果偏高,需连接盛碱石灰的干燥管;去掉装置B水蒸气金融业装置D导致测定结果偏高;
故答案为:装置D后连接一个盛碱石灰的干燥管;偏高;
(3)依据水的质量计算含氧元素质量得到铁矿石中氧的百分含量,测的反应后装置D增重1.35g,根据反应的实质,增加的是水的质量,根据质量守恒定律,所以铁矿石中氧的百分含量是:$\frac{\frac{1.35g}{18g/mol}×16g/mol}{5.0g}$×100%=24%,一氧化碳有毒不能排放空气中,若将H2换成CO,则还需补充尾气吸收装置,不测定D装置的净增质量,通过测定物理量装置C反应前后质量变化计算含氧量,
故答案为:24%;尾气处理;
(4)将原溶液稀释到250mL,需要使用的玻璃仪器仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,还缺少250mL容量瓶,
故答案为:250mL容量瓶;
(5)向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸后可以降低氯气的溶解度,赶走溶液中溶解的过量的Cl2,
故答案为:赶走溶液中溶解的过量的Cl2;
(6)根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI),即:0.5000mol•L-1×0.020L=c(Fe3+)×0.02L,解得c(Fe3+)=0.5mol•L-1,所以铁元素的百分含量为:$\frac{0.5000mol/L×0.250L×56g/mol}{10.0g}$×100%=70%,
铁的氧化物的化学式为Fe5O6,
故答案是:70%.
点评 本题考查了探究铁矿石中氧元素和铁元素的含量的方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力;该类试题综合性强,理论和实践的联系紧密,要求学生必须认真、细致的审题,联系所学过的知识和技能,全面细致的思考才能得出正确的结论.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 | |
| B. | 纤维素、PLA(聚乳酸)、维生素C、硝化纤维等都是高分子化合物 | |
| C. | 高容量的储氢材料的研制是推广应用燃料电池的关键问题之一 | |
| D. | 将呼吸产生的二氧化碳用石灰水吸收符合”低碳经济“原则 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极 被还原 | B. | 正极 被氧化 | C. | 负极 被还原 | D. | 负极 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现代元素周期表是按照元素相对原子质量由小到大排列而成的 | |
| B. | 同主族的元素,都是按从上到下的顺序电子层数逐渐增多 | |
| C. | 同周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8 | |
| D. | 同周期的元素的原子和离子半径,都是按从左到右的顺序逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
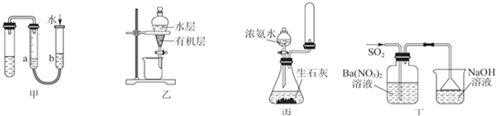
| A. | 用图甲的方法不能检查此装置的气密性 | |
| B. | 图乙可以作为CCl4萃取溴水后的分液装置 | |
| C. | 实验室用图丙所示装置制取少量氨气 | |
| D. | 图丁洗气瓶中的白色沉淀为BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
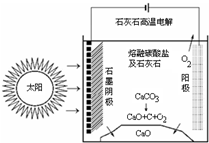 CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
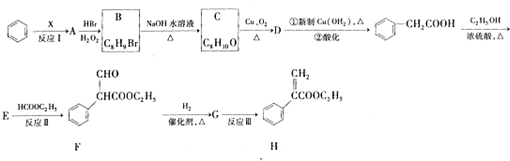
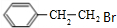 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基和酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基和酯基. .
. 制备
制备 的合成路线
的合成路线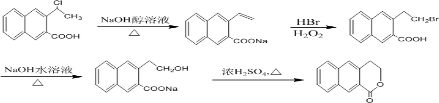 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 14C可用于文物年代的鉴定,14C和12C互为同素异形体 | |
| B. | 淀粉和纤维素都是高分子化合物,且都是非电解质 | |
| C. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| D. | 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com