
【题目】探究浓硫酸和铜的反应,下列装置或操作正确的是( )
A.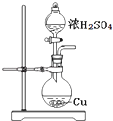 用装置进行铜和浓硫酸的反应
用装置进行铜和浓硫酸的反应
B.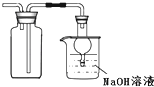 用装置收集二氧化硫并吸收尾气
用装置收集二氧化硫并吸收尾气
C.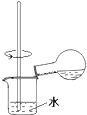 用装置稀释反应后的混合液
用装置稀释反应后的混合液
D.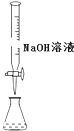 用装置测定余酸的浓度
用装置测定余酸的浓度
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应及平衡常数 | 温度/℃ | ||
500 | 800 | ||
①2H2(g)+CO(g)CH3OH(g)△H1 | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)CO(g)+H2O(g)△H2 | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g)△H3 | K3 | ||
(1)反应②的反应热△H20(填“>”、“<”或“=”);
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)K(B) (填“>”、“<”或“=”);
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示).500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时v(正)v(逆) (填“>”、“<”或“=”);
(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是; 
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将amol/L的乙酸与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO﹣),用含a和b的代数式表示该混合溶液中乙酸的电离常数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A.18gD2O中含有的中子数为10NA
B.常温常压下,49氦气中所含原子数为2NA
C.标准状况下,22.4LCH3CI中含C-H键数为3NA
D.1L0.3mol/LNH4NO3中所含NH4+数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关蛋白质分子的简要概念图,分析图示回答下列问题:
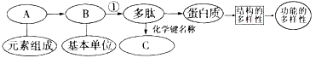
(1)此图中B代表__________,大约有______种,其分子结构通式为__________,C代表_______,其结构式是________。
(2)某蛋白质由104个氨基酸构成的含有四条肽链,在氨基酸形成该蛋白质过程中相对分子质量减少了__________。
(3)若该蛋白质是血红蛋白,说明蛋白质具有__________作用;若该蛋白质是酶,说明蛋白质具有__________作用;造成蛋白质功能多样性的原因(试从氨基酸的角度分析)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组溶液混合后,溶液一定呈中性的是( )
A.等体积、等物质的量浓度的氨水与盐酸混合
B.pH之和为14的氨水与硝酸等体积混合
C.pH之和为14的Ba(OH)2溶液与NaHSO4溶液等体积混合
D.等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于溶液的稀释下列说法正确的是( )
A.pH=3的醋酸溶液稀释100倍,pH=5
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10﹣6 molL﹣1
C.将1L 0.1molL﹣1的Ba(OH)2溶液稀释为2L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50mol CH4和1.20mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A.T2时CH4的平衡转化率为70.0%
B.该反应的△H>0、T1<T2
C.保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2 , 与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是配制250mL0.2mol·L-1氯化钠溶液的步骤:
①溶解②洗涤③移液④计算⑤定容⑥称量⑦盖好瓶塞,反复上下颠倒,摇匀。请你选出该溶液配制的操作先后顺序是
A. ②③⑤①⑥⑦④ B. ④⑥①③②⑤⑦
C. ④②⑤⑥①③⑦ D. ②⑥⑦④③⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.氢氧化钠的电子式: ![]()
B.质子数为53、中子数为78的碘原子: ![]()
C.水分子比例模型: ![]()
D.对硝基甲苯的结构简式: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com