
【题目】用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是 ( )
A.形成较多的白色沉淀B.排除SO42-以外的其它阴离子及Ag+的干扰
C.形成的沉淀纯度更高D.排除Ba2+以外的其它阳离子的干扰
科目:高中化学 来源: 题型:
【题目】我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下。
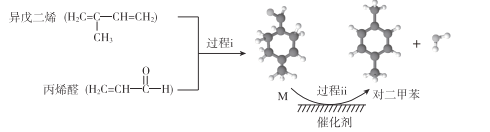
下列说法不正确的是
A. 过程i发生了加成反应
B. 中间产物M的结构简式为![]()
C. 利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D. 该合成路线理论上碳原子100%利用,最终得到的产物易分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。
已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。

(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择 ___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式__,该条件下氧化性:Fe2+ __ I2(选填“>”或“<”)。
③实验Ⅱ的目的是____。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+ >I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有 I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2,并用下图装置进行验证。
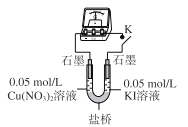
K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 ___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ __ I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是____。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题
(1)铵态氮肥不稳定,受热易分解.写出氯化铵(NH4Cl)受热发生分解反应的化学方程式 .
(2)乙烯能使溴水褪色,生成1,2﹣二溴乙烷(CH2 Br﹣CH2 Br).写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学习小组设计如下图装置制取SO2,研究其性质,并进一步探究不同浓度硫酸的氧化性
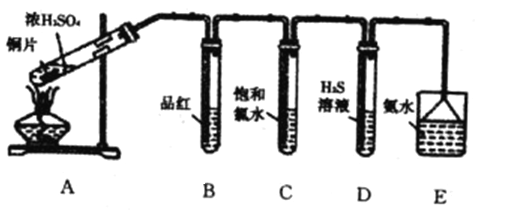
请回答下列问题:
(1)B、C、D分别用于检验SO2的性质,写出C中反应的离子方程式________________。
(2)实验中观察到D中有浑浊出现,有同学提出此现象不能证明SO2具有氧化性。
请简述理由:______________________________________________。
(3)E装置的作用为_____________________________。
Ⅱ.某学习小组设计并完成如下实验:称取一定量的还原铁粉放入一定体积的浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y中含有SO2、H2。
(4)溶液X中一定大量含有的金属阳离子是___________,简述如何检验溶液X中该离子______________________。
(5)为了测定气体Y中SO2的含量,将2.24L(标准状况)气体Y通入到200.00mL 0.2000mol/L酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗浓度为0.0500mol/L的KHC2O4标准液20.00mL。
①室温下,0.05mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。滴定操作时,标准液应装在
___________(填仪器名称)中;滴定终点的现象为______________________________。
②气体Y中SO2的物质的量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在l0L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率![]() 可表示为
可表示为
A. ![]() =0.010mol/(L·s) B.
=0.010mol/(L·s) B. ![]() =0.0010 mol/(L·s)
=0.0010 mol/(L·s)
C. ![]() =0.0010 mol/(L·s) D.
=0.0010 mol/(L·s) D. ![]() =0.0045 mol/(L·s)
=0.0045 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在标准状况下,气体摩尔体积约为22.4L/mol。则在常温常压下(25℃,101kPa)0.2mol气体A的体积为 ( )
A.4.48LB.大于4.48LC.小于4.48LD.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K= ![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.该反应可表示为X(g)+2Y(g)═2Z(g)+2W(g)
B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C.增大反应容器的压强,该反应速率一定增大
D.升高温度,W(g)体积分数增加,则正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C. H2SO4加入Ba(OH)2溶液中:Ba2++SO42-=BaSO4↓
D. 盐酸酸化的H2O2加入FeSO4溶液中:Fe2++H2O2+2H+= Fe3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com