
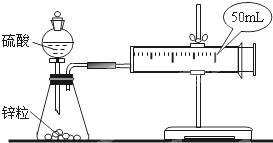
 两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.| n |
| v |


科目:高中化学 来源: 题型:
| A、①②③④⑤⑥ |
| B、④③⑥⑤①② |
| C、③⑥⑤④①② |
| D、③⑥⑤①④② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
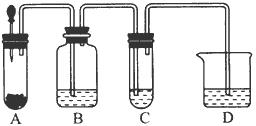 小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)
小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)查看答案和解析>>
科目:高中化学 来源: 题型:
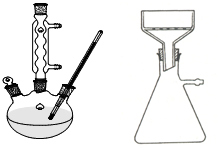 某实验室制取苯甲酸的过程如下:
某实验室制取苯甲酸的过程如下: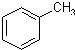 +2KMnO4
+2KMnO4| 反应Ⅰ |
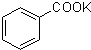 +MnO2+KOH+H2O
+MnO2+KOH+H2O| 温度/℃ | 4 | 18 | 75 |
| 溶解度/[g?(100gH2O)-1] | 0.18 | 0.27 | 2.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、油脂和蛋白质是基本营养物质 |
| B、蛋白质水解的最终产物是多肽 |
| C、糖尿病人不能食用含糖和淀粉的食品 |
| D、向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、Cl2既是氧化剂,又是还原剂 |
| B、3 mol氯气参加反应转移5 mol电子 |
| C、氧化产物的物质的量是还原产物的物质的量的5倍 |
| D、每有1 mol原子被氧化的同时就有5 mol原子被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+43.5 kJ/mol |
| B、-67.7 kJ/mol |
| C、+67.7 kJ/mol |
| D、-43.5 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com