
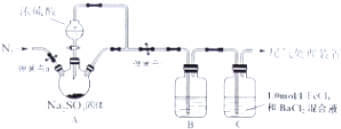
分析 (1)根据盛放浓硫酸的仪器的构造可知该仪器为分液漏斗;
(2)必须根据冷却后长导管中是否出现水柱进行判断该装置气密性;
(3)氧气能将二氧化硫氧化,所以鼓入氮气的目的是排净空气防止干扰实验;
(4)证明二氧化硫为酸性氧化物,可以使用酸碱指示剂检验,如蓝色石蕊试液,而酸性溶液不能使酚酞变色,据此进行判断;
(5)二氧化硫能够被铁离子氧化生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,证明了二氧化硫具有还原性,据此写出反应的离子方程式.
解答 解:(1)根据图示装置可知,盛放浓硫酸的仪器为分液漏斗,
故答案为:分液漏斗;
(2)检验装置中A、B两部分的气密性,进行的操作是:关闭弹簧夹a、打开弹簧夹b,用酒精灯在三口烧瓶下微热,观察到B中长导管口有明显气泡现象,冷却后长导管中出现一段水柱,说明该装置气密性良好,否则无法判断该装置的气密性是否良好,
故答案为:不合理;
(3)氧气、硝酸根离子都能将二氧化硫氧化,所以如果装置中含有氧气,会干扰实验,所以排入氮气的目的是排净空气防止干扰实验,
故答案为:排净装置中的空气,防止溶液中SO2被空气中的O2氧化而干扰实验;
(4)A.二氧化硫溶液为酸性溶液,不能使无色酚酞溶液变色,无法检验二氧化硫为酸性氧化物,故A错误;
B.二氧化硫溶液显示酸性,能够使蓝色石蕊试剂变红,可以证明二氧化硫为酸性氧化物,故B正确;
C.二氧化硫能够使红色品红溶液褪色,证明了二氧化硫漂白性,无法证明二氧化硫为酸性氧化物,故C错误;
D.KI淀粉混合溶液与二氧化硫不发生反应,无法证明二氧化硫为酸性氧化物,故D错误;
故答案为:B;
(5)氯化铁具有氧化性,能够将二氧化硫氧化为硫酸,同时证明二氧化硫具有还原性,反应的离子方程式为:Ba2++2Fe3++SO2+2H2O=2Fe2++BaSO4↓+4H+,
故答案为:还原;Ba2++2Fe3++SO2+2H2O=2Fe2++BaSO4↓+4H+.
点评 本题考查了性质实验方案的设计,题目难度中等,明确二氧化硫的性质及检验方法为解答关键,注意掌握性质实验方案设计的设计及评价原则,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 通过澄清石灰水 | |
| B. | 先通过碳酸氢钠溶液,再通过澄清石灰水 | |
| C. | 通过品红溶液 | |
| D. | 先通过足量的溴水,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
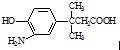 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质有7种不同环境的氢原子 | |
| C. | 该物质遇FeCl3溶液显色,1mol该物质最多能与含1mol Br2的溴水发生取代反应 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
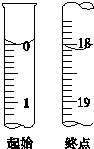 测定产品纯度
测定产品纯度查看答案和解析>>
科目:高中化学 来源: 题型:解答题
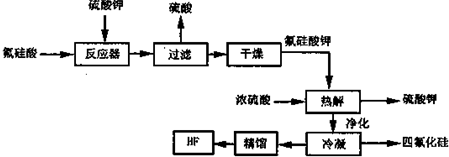
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 操作 | 现象 | 结论或目的 |
| (1)取少量溶液于试管中,向溶液中加入足量NaCl溶液 | - | 除尽Ag+ |
| (2)取少量上述溶液于试管中加入KSCN溶液,振荡 | 溶液变血红色 | 存在Fe3+ |
| (3)取(1)中少量上述溶液于试管中,加入酸性KMnO4溶液,振荡 | 紫色消失 | 存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com