
| A. | 四种元素A、B、C、D分别为O、Ca、Na、Ar | |
| B. | 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na 2O2等 | |
| C. | 元素A、C简单离子的半径大小关系为A<C | |
| D. | 元素B、C活泼性为B>C |
分析 A、B、C、D四种元素,A元素是地壳中含量最多的元素,则A是O元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和,则其原子核外电子数=2×(2+8)=20,则B是Ca元素;C元素是第3周期还原性最强元素,则C是Na元素,D元素在第3周期中,其单质是非常稳定的气体,则D是Ar元素,以此来解答.
解答 解:由上述分析可知,A为O,B为Ca,C为Na,D为Ar,
A.四种元素A、B、C、D分别为O、Ca、Na、Ar,故A正确;
B.元素O、Ca、Na两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等,故B正确;
C.O2-、Na+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Na+,故C错误;
D.由金属活动性顺序表可知,金属性Ca>Na,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 严格控制硝酸厂的尾气处理 | |
| B. | 倡导使用无磷洗衣粉 | |
| C. | 研究新型催化剂,消除汽车尾气污染 | |
| D. | 禁止使用含氟电冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
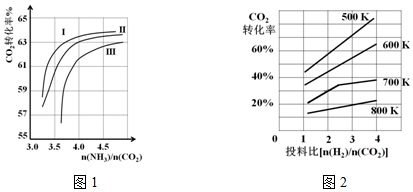
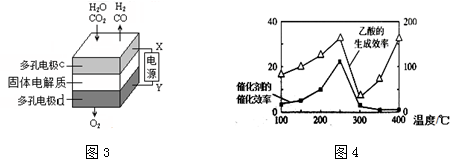
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解Na2SO3溶液,可再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)下列说法正确的是( )
电解Na2SO3溶液,可再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)下列说法正确的是( )| A. | 图中a极要连接电源的负极,C口流出的物质是亚硫酸 | |
| B. | b放电的电极反应式为SO32-+H2O-e-═SO42-+2H+ | |
| C. | 电解过程中若消耗12.6g Na2SO3,则阴极区变化的质量为4.4g(假设该过程中所有液体进出口密闭) | |
| D. | 电子由a经内电路流向b电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
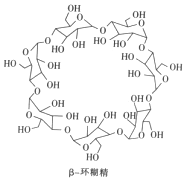 β-环糊精(简称β-CD)是淀粉部分水解后的产物,其在食品加工、医学及日用化工中的用途非常广泛.下列有关β-CD的说法不正确的是( )
β-环糊精(简称β-CD)是淀粉部分水解后的产物,其在食品加工、医学及日用化工中的用途非常广泛.下列有关β-CD的说法不正确的是( )| A. | 有两种含氧官能团 | B. | 酸性条件下能继续水解 | ||
| C. | 相对分子质量为1134 | D. | 其结构中含有20个羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2HI+Cl2═2HCl+I2 | B. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | ||
| C. | CH2Br2+Cl2→CHClBr2+HCl | D. | Zn+CuSO4═ZnSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
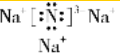 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com