
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |


科目:高中化学 来源: 题型:
| A、物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 |
| B、100 mL 1 mol?L-1的盐酸和50 mL 2 mol?L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 |
| C、100 mL pH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 |
| D、100 mL pH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 空气污染指数 | 0~50 | 51~100 | 101~150 | 151~200 | 201~250 | 251~300 | >300 |
| 空气质量状况 | 优 | 良 | 轻度污染 I | 轻度污染 II | 中度污染 I | 中度污染 II | 重度污染 |
| 空气质量级别 | I | II | III | III | IV | IV | V |
| 城市 | 首要污染物 | 空气污染指数 | 空气质量级别 |
| 上海 | 可吸入颗粒物 | 111 | Ⅲ轻度污染I |
| 淄博 | 可吸入颗粒物 | 103 | ? |
| 昆明 | 二氧化硫 | 61 | Ⅱ良 |
| 海口 | -- | 24 | Ⅰ优 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg?L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg?L-1) | ≤23 000 | ≤150 |
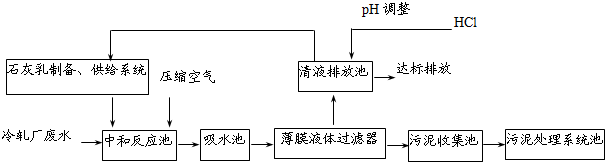
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液体分层,上层为四氯化碳层,黄色 |
| B、液体分层,上层为水层,紫色 |
| C、液体分层,下层为四氯化碳层,紫色 |
| D、液体分层,下层为水层,黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿 |
| B、润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次 |
| C、用瓷坩埚加热熔化碳酸钠固体 |
| D、Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 初始浓度c/mol?L-1 | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.001 0 | 290 |
| ② | 1.60 | 0.20 | 0.001 0 | 145 |
| ③ | 0.80 | 0.40 | 0.001 0 | 145 |
| ④ | 0.80 | 0.20 | 0.002 0 | 580 |
| A、增大c(CH3COCH3),v(Br2)增大 |
| B、实验②和③的v(Br2)相等 |
| C、增大c(HCl),v(Br2)增大 |
| D、增大c(Br2),v(Br2)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com