
【题目】设NA为阿伏加德罗常数,下列叙述正确的是
①常温下64 g S4和S8混合物中含有原子数为2NA
②2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA
③1.0L1.0mol/LCH3COOH溶液中,CH3COOH分子数为NA
④8.8g乙酸乙酯中含共用电子对数为1.4NA
⑤足量铁在1mol氯气中加热反应,铁失去的电子数为3NA
⑥常温常压下,17g甲基(-14CH3)所含的中子数为9NA
⑦标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
⑧lmolC15H32分子中含碳碳键数目为14NA
A. ①③⑤⑦B. ①②④⑧C. ②③⑥⑧D. ①②⑥⑧
【答案】B
【解析】
①S原子相对原子质量是32,所以常温下64 g S4和S8混合物中含有原子物质的量n(S)=![]() =2mol,所以含有S原子数为2NA,①正确;
=2mol,所以含有S原子数为2NA,①正确;
②乙烯和聚乙烯最简式是CH2,其式量为14,2.8g乙烯和2.8g聚乙烯中含最简式的物质的量为n=![]() =0.2mol,所以其中含有碳原子数均为0.2NA,②正确;
=0.2mol,所以其中含有碳原子数均为0.2NA,②正确;
③CH3COOH是弱电解质,在溶液中会发生部分电离,所以1.0L1.0mol/LCH3COOH溶液中,含有的CH3COOH分子数小于NA,③错误;
④乙酸乙酯结构简式为CH3COOCH2CH3,一个分子中含有共用电子对数目为14个,8.8g乙酸乙酯的物质的量是0.1mol,则其中含共用电子对数为1.4NA,④正确;
⑤Fe与Cl2反应产生FeCl3,由于足量铁在1mol氯气中加热反应,Cl2不足,以Cl2为标准计算电子转移数目,所以铁失去的电子数为2NA,⑤错误;
⑥17g甲基(-14CH3)的物质的量是1mol,由于一个甲基中含有8个中子,所以常温常压下,17g甲基(-14CH3)所含的中子数为8NA,⑥错误;
⑦在标准状况下氯仿呈液态,不能使用气体摩尔体积计算,⑦错误;
⑧C15H32属于烷烃,1个该物质分子中含有14个C-C键,则lmolC15H32分子中含碳碳键数目为14NA,⑧正确;
可见叙述正确是①②④⑧,故合理选项是B。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. Ba(HCO3)2溶液与少量的NaOH溶液反应:Ba2++HCO![]() +OH-=BaCO3↓+H2O
+OH-=BaCO3↓+H2O
B. 次氯酸钙溶液中通入过量的二氧化碳 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
C. 用氨水吸收少量二氧化硫 OH-+SO2=HSO3-
D. 硫酸与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.氢氧化钠的摩尔质量是40 g
B.1 mol NaOH的质量是40 g/mol
C.1 g H2和1 g N2所含分子数相等
D.等物质的量的N2、CH4、CO、H2O中,所含分子数一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产钠和烧碱的原理如下:
①电解熔融氯化钠制钠:2NaCl(熔融) ![]() 2Na+Cl2↑
2Na+Cl2↑
②电解饱和食盐水制烧碱:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
下列有关说法正确的是
A.在反应①和②中,氯化钠均既是氧化剂,又是还原剂
B.在反应①中氯气是还原产物,在反应②中氢气是还原产物
C.若标准状况下生成等体积的气体,则反应①和②中消耗的氯化钠质量相等
D.若消耗等质量的氯化钠,则反应①和②中转移电子总数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由1~18号元素中部分元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为____,其阴、阳离子个数比为____。
(2)化合物E溶于水中的电离方程式为____。
(3)实验室将物质C通常保存在____中,请写出反应①的离子方程式,并用单线桥标出电子转移的方向和数目____。
(4)反应②的化学方程式为____。
(5)有两个分别装有H和I固体的试剂瓶,因标签脱落而无法区分。若让你鉴别它们,下列试剂或方法中可选用的有____。
A 澄清石灰水 B 稀盐酸 C 加热,称重 D 焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是

A. 气体A是NO2
B. X溶液中肯定存在Fe2+、Al3+、NH4+、SO42-
C. 溶液E和气体F不能发生化学反应
D. X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为 “氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 发生的反应为2Na+Cl2![]() 2NaCl
2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL1mol·L-1元酸HA溶液中,不断滴加1mol·L-1的NaOH溶液所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Kα(HA)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
I.CO+2H2![]() CH3OH II.CO2+3H2
CH3OH II.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
Ⅲ.CO2+H2![]() CO+H2O
CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.51 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式______________________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)直接甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
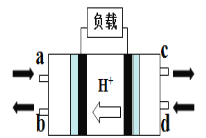
①c处产生的气体是________
②负极的电极反应式是____________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
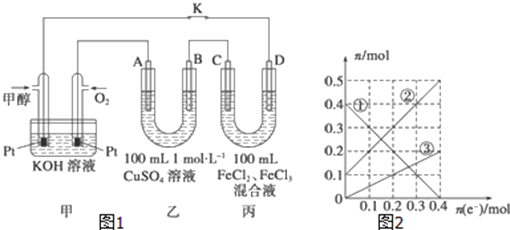
①乙中B极的电极反应式_______;
②乙中A极析出的气体在标况下的体积________;
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则③线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____ml 5mol/L NaOH溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com