
 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
分析 实验探究在加热条件下FeSO4的分解产物,Ⅱ装置烧杯中水的温度应控制在50℃,防止SO3液化或凝固,装置III是检验是否有三氧化硫,可以选用氯化钡溶液,如果有白色沉淀生成说明有三氧化硫,装置IV是检验是否有二氧化硫,二氧化硫能使品红褪色,也可以使高锰酸钾溶液褪色,装置V中试剂为NaOH溶液吸收多余的二氧化硫气体防止污染空气,
(1)亚铁离子易被氧化具有还原性;
(2)①安全瓶的作用是可以防止倒吸;当温度高于44.8°C时三氧化硫为气体状态;
②装置III是检验是否有三氧化硫,装置IV是检验是否有二氧化硫,根据二者的性质选择试剂;
③二氧化硫会污染空气,要用氢氧化钠溶液来处理尾气;
④检验三价铁离子用硫氰化钾溶液;检验二价铁离子用K3[Fe(CN)6]溶液;
⑤反应过程中FeSO4固体分解为二氧化硫、三氧化硫、FeO、Fe2O3,完全分解后得到11.2g固体为氧化铁和氧化亚铁,质量减少的为二氧化硫和三氧化硫的总质量,据此列方程组计算.
解答 解:(1)亚铁离子具有还原性,易被氧气氧化,反应方程式为4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O,
故答案为:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O;
(2)①SO3的沸点是44.8°C,当温度高于44.8°C时三氧化硫为气体状态,把试管浸泡在50℃的热水浴中能防止SO3液化或凝固,产生的气体极易和溶液反应时,会产生倒吸,所以装置II的试管能防止溶液倒吸入装置Ⅰ中(或安全瓶),
故答案为:50℃;防止产生倒吸:
②装置III是检验是否有三氧化硫,可以选用氯化钡溶液,如果有白色沉淀生成说明有三氧化硫;装置IV是检验是否有二氧化硫,二氧化硫能使品红褪色,也能使酸性高锰酸钾溶液褪色,所以可以选用二者来检验二氧化硫;
故答案为:C;产生白色沉淀;B、E;
③二氧化硫会污染空气,所以要用氢氧化钠溶液来吸收剩余的二氧化硫,其反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;
④检验三价铁离子用硫氰化钾溶液,溶液变红色,证明有三价铁离子,进而说明固体产物中含有氧化铁;检验二价铁离子用K3[Fe(CN)6]溶液,溶液中生成蓝色沉淀,说明有二价铁离子,即证明固体产物中含有FeO;
故答案为:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | |
| 固体中含有FeO |
点评 本题考查亚铁离子和三价铁离子之间的相互转化、性质及实验方案的设计、评价和有关计算的知识,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
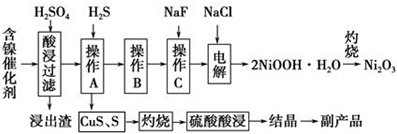
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
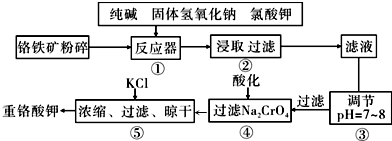
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为O2+4H++4e-═2H2O | |
| C. | 通入CH4的一极的电极反应式为CH4+2O2+4e-═CO2+2H2O | |
| D. | 负极的电极反应式为CH4+10OH--8e-═CO32-+7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互称为同分异构体的物质不可能具有相同的通式 | |
| B. | 具有相同官能团的有机物不一定是同系物 | |
| C. | 糖类、油脂、蛋白质都是仅含C、H、O元素的有机物 | |
| D. | 燃烧产物是CO2、H2O的有机物一定烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
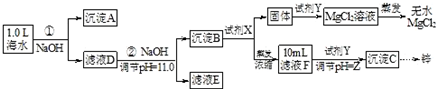
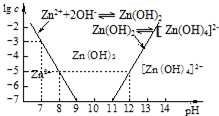
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | Ka1=1.54×10-2 |
| Ka2=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 在1mol•L-1NaHA(酸式盐)溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 已知某温度下常见弱酸的电离平衡常数如上表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 | |
| D. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com