
���� ��1�����ݷ�Ӧ�����������ƽ��д��ѧ����ʽ�����ݶ��ɹ�ϵ�жϣ�0.4molҺ̬�º�0.8mol H2O2���ǡ�÷�Ӧ������1molҺ̬����ȫ��Ӧ�ų�641.75kJ��������
��2�����ݷ�Ӧ����Ի�����Ӱ�������
��� �⣺��1����Ӧ����ʽΪ��N2H4+2H2O2=N2+4H2O��0.4molҺ̬�·ų�256.7KJ����������1molҺ̬�·ų�������Ϊ��$\frac{256.7kJ}{0.4}$=641.75kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g����H=-641.75kJ/mol��
�ʴ�Ϊ��N2H4��g��+2H2O2��l��=N2��g��+4H2O��g����H=-641.75kJ/mol��
��2���˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ������������⣬����һ���ܴ���ŵ��Dz���Ϊ������ˮ���ǿ����ɷֲ�����ɻ�����Ⱦ��
�ʴ�Ϊ�����ﲻ����ɻ�����Ⱦ��
���� ���⿼�鷴Ӧ�����ʱ��Ӧ�ã��Ǹ߿��еij������ͣ���ȷ�Ȼ�ѧ����ʽ����дԭ��Ϊ���ؼ������������ǿ���������У������ϻ�����䣬����������ѧ��ѧϰ��ѧ����Ȥ�������ڵ���ѧ����ѧϰ�����ԣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | x=0.4a��2Fe2++Cl2=2Fe3++2Cl- | |
| B�� | x=1.5a��2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- | |
| C�� | x=a��2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| D�� | x=0.6a��2Br-+Cl2=Br2+2Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
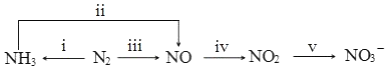
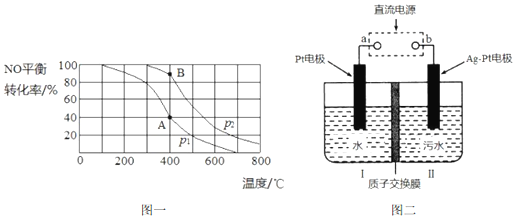
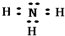 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
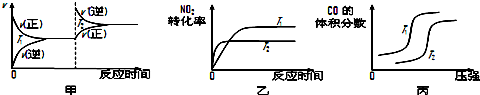
| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2O��/mol | 0.10 | 0.20 | 0.20 |
| n��CO��/mol | 0.10 | 0.10 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
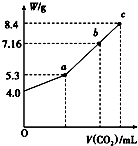 ��100mL��NaOH��Һ��ͨ��CO2��ַ�Ӧ���ڼ�ѹ�ͽϵ��¶��£�С�ĵؽ���Һ���ɣ��õ���ɫ����M��ͨ��CO2���������״������M������W�Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
��100mL��NaOH��Һ��ͨ��CO2��ַ�Ӧ���ڼ�ѹ�ͽϵ��¶��£�С�ĵؽ���Һ���ɣ��õ���ɫ����M��ͨ��CO2���������״������M������W�Ĺ�ϵ��ͼ��ʾ���Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
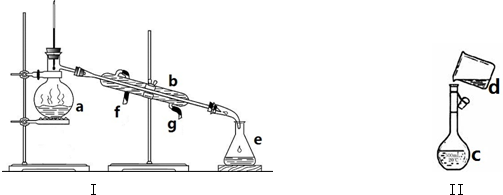
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ü��������ˮ�����˵ķ�����ȥNaCl��Һ�л��е�AlCl3 | |
| B�� | ��ȥNaCl��Һ��������Na2S������AgCl���ٹ��� | |
| C�� | ��MgCl2��Һ�м���CaCO3��ĩ����ֽ������˿ɳ�ȥ����FeCl3 | |
| D�� | ��ȥFeCl3��Һ��������CuCl2�������������ۣ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ǵ�ѹǿ��������¶Ⱦ���ͬʱ�����������������m��H2����m��O2����m��CO2�� | |
| B�� | �����ǵ��¶Ⱥ�ѹǿ����ͬʱ������������ܶȣ��ѣ�H2�����ѣ�02�����ѣ�C02�� | |
| C�� | �����ǵ��������¶ȡ�ѹǿ����ͬʱ����������������V��CO2����V��O2����V��H2�� | |
| D�� | �����ǵ��¶Ⱥ��ܶȶ���ͬʱ�����������ѹǿ��P��H2����P��O2����P��CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +172.22kJ/mol | B�� | -172.22kJ/mol | C�� | -392.92kJ/mol | D�� | +392.92kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com