
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
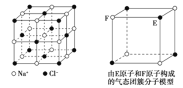
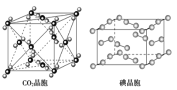
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.该气态团簇分子的分子式为E4F4或F4E4
C.在CO2 晶体中,一个CO2 分子周围有4个CO2 分子紧邻
D.在碘晶体中,碘分子的排列有两种不同的方向
【答案】C
【解析】
A.氯化钠晶体中,距Na+最近的Cl-是6个,钠离子的配位数是6,6个氯离子形成正八面体结构,故A正确;
B.该模型是分子模型,据图可知一个分子中含有4个E原子和4个F原子,则该气态团簇分子的分子式为E4F4或F4E4,故B正确;
C.根据CO2晶胞结构图可知,以顶点上的CO2分子为例,距离其最近的CO2分子分布在经过这个顶点的各个面的面心上,一个顶点被8个晶胞共用,所以这样的面共有![]() =12个,所以一个CO2分子周围有12个CO2分子紧邻,故C错误;
=12个,所以一个CO2分子周围有12个CO2分子紧邻,故C错误;
D.根据晶胞结构图可知,碘为分子晶体,晶胞中占据顶点和面心,碘分子在顶点和面心有2种不同的方向,故D正确;
故答案为C。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
A.①⑤B.②④C.③④D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a-Fe(III)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为①H2 (g)=2H(g) △H1,②N2(g)+2H(g)2(NH)(g) △H2, ③(NH)(g)+H(g)![]() (NH2)(g) △H3, ④(NH2)(g)+H(g)
(NH2)(g) △H3, ④(NH2)(g)+H(g) ![]() NH3 (g) △H4,总反应为N2 (g)+3H2(g)
NH3 (g) △H4,总反应为N2 (g)+3H2(g)![]() 2NH3 (g) △H。下列说法正确的是
2NH3 (g) △H。下列说法正确的是
A. 催化剂能够有效降低反应的活化能和改变反应的焓变
B. 增大压强和使用高效催化剂均有利于提高总反应的平衡转化率
C. 反应①和总反应均为放热反应
D. △H=3△H1+△H2+2△H3+2△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2= +72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
CO(NH2)2(s)+H2O(g) △H3= -86.98kJ/mol
①反应Ⅰ的△H1=______________。
②一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A 容器内气体总压强不再变化
B NH3与CO2的转化率相等
C 容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=___________。
②该反应为____________(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
④在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,此时反应向________(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设Na为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) △H1 =a kJ mol -1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) △H2 =bkJ mol-1
键能定义:在标准状况下,将1 mol气态分子AB(g)解离为气态原子
A(g)、B(g)所需的能量。已知1 mol氧气的键能为xkJ。其他数据如下 表所示,下列说法正确的是
化学键 | C—O | C—H | O—H |
键能/(kJ mol-1) | 798 | 413 | 463 |
A.上文中x=![]()
B.H2O(g) = H2O(1)的△S<0、△H=(a — b) kJ mol -1
C.当有4NA个O—H键生成时,反应放出的热量为a kJ
D.利用反应①设计的原电池电解精炼铜,当负极输出0.2NA个电子时. 理论上电解槽的阴极质量增重6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
查看答案和解析>>
科目:高中化学 来源: 题型:
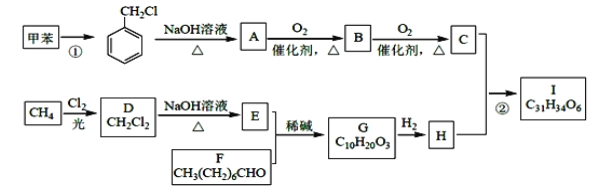
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
已知:a、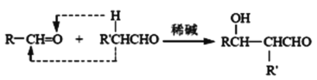
b、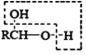
![]() RCHO
RCHO
回答下列问题:
(1)反应①所需试剂、条件分别是____________;A的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_________________。
(3)E的结构简式为______________;I 中所含官能团的名称是____________。
(4)化合物W 的相对分子质量比化合物C 大14,且满足下列条件①遇FeCl3 溶液显紫色;②能发生银镜反应,W 的可能结构有____种。其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式________。
(5)设计用甲苯和乙醛为原料制备 ![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为A![]() B
B![]() 目标产物。____________
目标产物。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.酸碱中和滴定时,滴定管和锥形瓶在使用前均需用待装液润洗
B.清洗碘升华实验所用试管,先用稀盐酸清洗,再用水清洗
C.实验室从海带提取单质碘的方法是:取样![]() 灼烧
灼烧![]() 溶解
溶解![]() 过滤
过滤![]() 萃取
萃取
D.配制![]() 溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
溶液时未恢复至室温就转移并定容,所得溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中有广泛应用.
![]() 已知:CO可将部分氮的氧化物还原为
已知:CO可将部分氮的氧化物还原为![]() .
.
反应Ⅰ:![]()
反应Ⅱ:![]()
写出CO将![]() 还原为NO的热化学方程式 ______ .
还原为NO的热化学方程式 ______ .
![]() 在密闭容器中充入5molCO和4molNO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系.
在密闭容器中充入5molCO和4molNO,发生上述反应I,图1为平衡时NO的体积分数与温度、压强的关系.
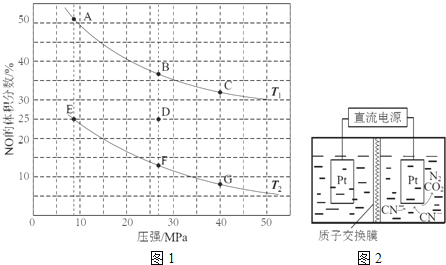
回答下列问题:
![]() 温度:
温度:![]() ______
______ ![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率
某温度下,在体积为2L的密闭容器中,反应进行10分钟放出热量373kJ,用CO的浓度变化表示的平均反应速率![]() ______ .
______ .
![]() 某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数
某温度下,反应达到平衡状态D点时,容器体积为2L,此时的平衡常数![]() ______
______ ![]() 结果精确到
结果精确到![]() ;若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中
;若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中![]() 点中的 ______ 点
点中的 ______ 点
![]() 某温度时,亚硝酸银
某温度时,亚硝酸银![]() 的
的![]() 、
、![]() 的
的![]() ,当向含
,当向含![]() 、
、![]() 混合溶液中加入
混合溶液中加入![]() 溶液至
溶液至![]() 恰好完全沉淀
恰好完全沉淀![]() 即
即![]() 浓度等于
浓度等于![]()
![]() 时,
时,![]() ______ .
______ .
![]() 如图2,在酸性条件下,电解水中
如图2,在酸性条件下,电解水中![]() 可转化为
可转化为![]() 和
和![]() ,请写出阳极的电极反应式 ______ .
,请写出阳极的电极反应式 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com