
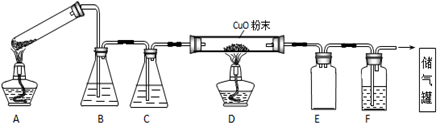
分析 (1)可燃气体点燃前要验纯;纯度不足时一氧化碳气体会发生爆炸,所以先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;
(2)给试管中的固体加热时,试管口应该稍稍向下倾斜;根据图示装置及实验目的可知:B和F装置的作用相同均是除去二氧化碳;E为安全瓶,起到防止倒吸的作用;
(3)①根据配制一定物质的量浓度的溶液的方法判断需要的仪器;
②根据反应原理及高锰酸钾的物质的量计算出该草酸晶体中含有草酸的物质的量、质量,再计算出结晶水的物质的量,最后计算出x.
解答 解:(1)避免发生爆炸现象,所以点燃D处酒精灯前必须要进行检验CO纯度;CO气体的纯度不足时会发生爆炸现象,所以应该先点燃A处酒精灯,用生成的CO将装置中空气排净,然后再点燃D处的酒精灯;熄灭酒精灯时恰好相反,先熄灭D处酒精灯,然后再熄灭A处酒精灯,所以正确的操作方法为:①③④②;
故答案为:验纯;①③④②;
(2)反应中有水生成,容易导致试管炸裂,所以A装置中试管口应向下倾斜;B和F装置的作用相同均是除去二氧化碳,则BF中的溶液为NaOH;E为安全瓶,起到防止F中溶液倒吸进入D中,引起试管炸裂;
故答案为:试管口应向下倾斜;NaOH;防止倒吸;
(3)①配制草酸溶液除需要玻璃棒、烧杯,配制100mL溶液需要选用100mL容量瓶,定容时还需要胶头滴管,故答案为:100mL容量瓶、胶头滴管;
②16mL 0.0500mol/L高锰酸钾溶液中含有高锰酸钾的物质的量为:0.0500mol/L×0.016L=0.0008mol,100mL该草酸溶液能够消耗高锰酸钾的物质的量为:0.0008mol×$\frac{100mL}{20mL}$=0.004mol,根据反应2MnO4-+5H2C2O4+6H+=10CO2+2Mn2++8H2O可知1.08g样品中含有草酸的物质的量为0.004mol×$\frac{5}{2}$=0.01mol,草酸的质量为90g/mol×0.01mol=0.9g,含有结晶水的物质的量为$\frac{1.08g-0.9g}{18}$=0.01mol,则该草酸晶体中x=$\frac{0.01mol}{0.01mol}$=1,
故答案为:1.
点评 本题考查了探究物质组成的实验方案设计,题目难度中等,熟练掌握化学实验基本操作方法为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | HCl的溶解性强于H2S | B. | 氯的最高价为+7价 | ||
| C. | HCl的稳定性强于H2S | D. | HClO的氧化性强于H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2为0.1 mol•L-1 | B. | X2为0.1 mol•L-1 | ||
| C. | Y2为0.35 mol•L-1 | D. | Z为0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
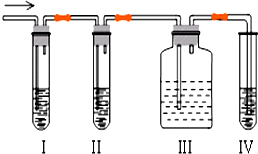 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{10}{11}$ | B. | $\frac{4}{25}$ | C. | $\frac{4}{11}$ | D. | $\frac{4}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | Na2S | 漂粉精溶液 | 酸性:盐酸>氢硫酸>次氯酸 | |
| B | 浓盐酸 | KMnO4 | Na2S溶液 | 氧化性:KMnO4>Cl2>S | |
| C | 浓氨水 | NaOH | 酚酞 | 碱性:NaOH>NH3•H2O | |
| D | 浓硫酸 | Na2SO3 | BaCl2溶液 | SO2与可溶性钡盐均不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、Cl- | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、Cl-、Ca2+、Na+ | D. | Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3所含的分子数目为NA | |
| B. | 0.2molH2O2催化分解,转移电子数为0.2NA | |
| C. | 0.1mol/L的100mLH2SO3溶液中,含有的离子数约为0.03NA | |
| D. | 6.25 mL1 mol/L浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com