
| A. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| B. | 室温下,测得氯化铵溶液pH<7:NH4++H2O=NH3•H2O+H+ | |
| C. | 石灰水中加入过量碳酸氢钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 用小苏打片治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
分析 A.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
B.铵根离子的水解为可逆反应,应该用可逆号;
C.碳酸氢钠溶液过量,反应生成碳酸钙沉淀、碳酸钠和水;
D.小苏打为碳酸氢钠,碳酸氢根离子不能拆开.
解答 解:A.用氢氧化钠溶液除去镁粉中的杂质铝,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故A正确;
B.室温下,测得氯化铵溶液pH<7,原因是铵根离子发生水解,正确的离子方程式为:NH4++H2O?NH3•H2O+H+,故B错误;
C.石灰水中加入过量碳酸氢钠溶液,离子方程式按照氢氧化钙的化学式组成书写,正确的离子方程式为:2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O,故C错误;
D.用小苏打片治疗胃酸过多,碳酸氢根离子不能拆开,正确的离子方程式为:HCO3-+H+═CO2↑+H2O,故D错误;
故选A.
点评 本题考查了离子方程式正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 相同状况下两电极上产生的气体体积之比为2:1 | |
| B. | 两电极上产生的气体质量之比为8:1 | |
| C. | 相同状况下两电极上产生的气体体积之比为4:1 | |
| D. | 若两电极上产生的气体质量比为16:3,则D2O与H2O的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应前用硫酸洗涤铂丝 | |
| B. | 用硫酸干燥Cl2、HCl、CO2、H2 | |
| C. | 用盐酸酸化KMnO4溶液滴入FeSO4溶液,证明Fe2+具有还原性 | |
| D. | 先加硝酸酸化,再加BaCl2溶液检验未知溶液中的SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
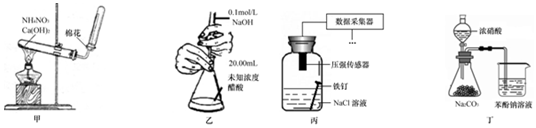
| A. | 用甲装置制取氨气 | |
| B. | 用乙装置测定醋酸浓度 | |
| C. | 用丙装置采集到的压强数据判断铁钉发生电化学腐蚀类型 | |
| D. | 用丁装置验证酸性:硝酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 除①④⑥以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
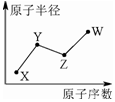 X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其单质都是双原子气体分子.它们原子半径随原子序数的变化如下图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | Y、W的最简单氢化物的水溶液能相互反应生成离子化合物 | |
| C. | 非金属性:Y>Z | |
| D. | X、Z、W形成的化合物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | 第三 | ||
| 3d54s1 | ⅥB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
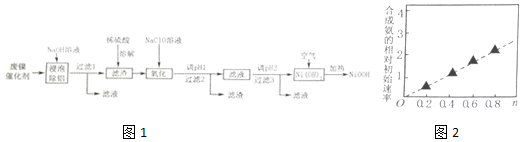
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com