
【题目】在同温同压下,a g气体A与b g气体B的分子数相同,下列说法中不正确的是( )
A. A与B两种气体的相对分子质量之比为a∶b
B. 在同温同压的条件下,A与B两种气体的密度之比为b∶a
C. 同质量的A、B两种气体的分子个数之比为b∶a
D. 相同条件下,同体积A气体与B气体的质量之比为a∶b
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol·L1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是______。
(2)本实验需量取浓硫酸的体积为___mL。
(3)在容量瓶使用方法中,下列操作不正确的是_____(填序号)。
A.使用容量瓶前检查它是否漏水
B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
C.将确量取的18.4mol·L1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况使所配制的稀硫酸浓度偏大是_____ (填序号)。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外电子排布式为 。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为 。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属 分子(选填“极性”“非极性”),其立体构型为 。
(3)橙红色晶体羰基钴[Co2(CO)8]的熔点为52℃,可溶于多数有机溶剂。该晶体属于 晶体,三种元素电负性由大到小的顺序为(填元素符号) 。配体CO中σ键与π键数之比是 。
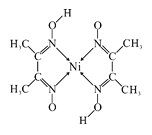
(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如上图所示,分子内的作用力不可能含有 (填序号)。
A离子键 B共价键 C金属键 D配位键 E氢键
(5)钨为熔点最高的金属,硬度极大,其晶胞结构如图所示,已知钨的密度为ρ g·cm-3,则每个钨原子的半径r= cm。(只需列出计算式)
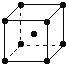
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)基态Ga原子价电子排布图为________。
(2)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___;与NO2+互为等电子体的微粒有_____(写出一种)。
(3)电负性:磷_____硫(填“>”或“<”);第一电离能磷大于硫的原因是________。
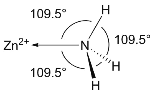
(4)NH3分子在独立存在时H-N-H键角为106.7°。如图[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:_______________________________。
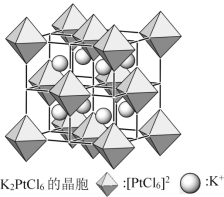
(5)已知图中正八面体为[PtCl6]2-离子,白球为K+,立方体晶胞边长为a pm,K2PtCl6的相对式量为M,阿伏加德罗常数的值为NA,其密度为________g·cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
C. 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电镀车间的含铬酸性废水中,铬的存在形式有Cr(Ⅵ)和Cr(Ⅲ)两种,其中以Cr(Ⅵ)的毒性最大。电解法处理含铬废水如图,铬最终以Cr(OH)3沉淀除去。下列说法正确的是

A. Fe为阳极,反应为Fe-2e-=Fe2+
B. 阴极反应为Cr2O72-+7H2O+6e-=2Cr(OH)3↓+8OH-
C. 阳极每转移3mol电子,可处理Cr(Ⅵ)物质的量为1mol
D. 离子交换膜为质子交换膜,只允许H+穿过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业中产生的NO是一种大气污染物,可以通过如下反应处理:2NO(g)+2CO(g) ![]() N2 (g)+ 2CO2(g); △H1。
N2 (g)+ 2CO2(g); △H1。
(1)已知:2CO(g)+O2(g)=2CO2(g);△H2=-566 kJ·mol-l,N2(g)+O2(g) ![]() 2NO(g); △H3=+181 kJ ·mol-l,则△H1=___________
2NO(g); △H3=+181 kJ ·mol-l,则△H1=___________
(2)在一定温度下,向体积为2L的密闭容器中充入4 moI NO、2 mol CO。
①若为恒容密闭容器,在10min时达到平衡状态,压强为原来的14/15,这段时间内,NO的平均反应速率为___________,平衡常数为___________L· mol-1,此时NO的转化率a%;平衡后,向恒容密闭容器中再充入2 mol NO、1 mol CO,重新达到平衡时,NO的转化率将___________(填“增大”、“不变”或“减小”);
②若为恒压密闭容器,平衡后NO的转化率为b%,则a%________b%(填“<”、“=”或>”)
(3)工业上,NO与CO混合气体以一定流速和一定的比例,通过填充有A、B催化剂的反应器,在A、B两种催化剂作用下,CO转化率与温度的关系如下图所示。
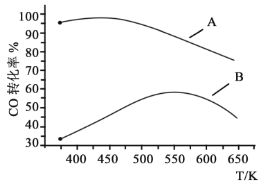
①工业上选择催化剂___________(填“A”或“B),理由是___________。
②在催化剂B作用下,高于550K时,CO转化率下降的理由可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42![]() 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的例子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
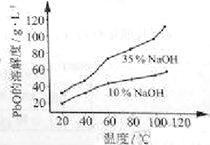
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_____(选填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为

A. 7∶2
B. 5∶4
C. 3∶5
D. 2∶7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com