
【题目】甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
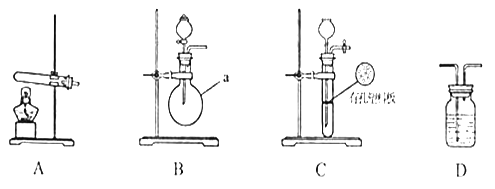
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量为m1 g、氧化铜反应后剩余固体的质量为m2 g生成氮气在标准状况下的体积V1 L。
乙小组测得:洗气前装置D的质量m3 g、洗气后装置后D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:__________________________________。
(2)检查A装置气密性的操作时___________________________________________。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为______________ |
乙小组 | _____ | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用:_____________________________ |
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为____________________。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是_______________________________ 。为此,乙小组在原有实验的基础上增加了一个装装有药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果.该药品的名称是____________________________。
【答案】 圆底烧瓶 连接导管,将导管插入水中;用手紧握试管或加热试管,导管口有气泡产生;松开手后或停止加热,导管内有水回流并形成一段稳定的水柱 (NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4 B 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-向逆方向移动,加快氨气逸出 5V1:7(m1-m2) 洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高 碱石灰(氢氧化钠、氧化钙等)
NH4++OH-向逆方向移动,加快氨气逸出 5V1:7(m1-m2) 洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高 碱石灰(氢氧化钠、氧化钙等)
【解析】本题主要考查对于测定氨分子中氮、氢原子个数比实验流程的评价。
(1)仪器a的名称:圆底烧瓶。
(2)检查A装置气密性的操作时连接导管,将导管插入水中;用手紧握试管或微微加热试管,导管口有气泡产生;松开手后或停止加热,导管内有水回流并形成一段稳定的水柱。
(3)
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为(NH4)2SO4+Ca(OH)2 |
乙小组 | B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用:氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O |
(4)(m1-m2)g为CuO中O的质量,NH3中H的物质的量为[(m1-m2)/8]mol,NH3中N的物质的量为(V1/22.4)mol×2=(V1/11.2)mol,所以氨分子中氮、氢的原子个数之比为5V1:7(m1-m2)。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高。为此,乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等)。


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质的说法中,错误的是
A. 硫是一种黄色晶体,易溶于水
B. 新制氯水应避光保存
C. 新制氯水具有漂白作用
D. 二氧化氮是红棕色、有刺激性气味的有毒气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在强碱性溶液中:Na+、K+、AlO2﹣、Cl﹣
B. pH=l的溶液中:HCO3﹣、NH4+、NO3﹣、Ca2+
C. 无色溶液中:Cu2+、NO3﹣、Cl﹣、H+
D. 无色溶液中:Na+、K+、ClO﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行如下实验,能达到实验目的的是

A. 瓶中盛满水,从B口进气,用排水法收集HCl气体
B. 瓶中盛适量浓硫酸,从A口进气来干燥NH3
C. 从B口进气,用排空气法收集CO2
D. 瓶中盛满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如图所示的关系图(部分产物、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。

己知:
Ⅰ Ⅱ
Ⅱ
请根据所学知识与本题所给信息回答下列问题:
(1)H的结构简式是________________。
(2)反应②、③的反应类型分别是________________、________________。
(3)反应①的化学方程式是_________________________。反应⑤的化学方程式是___________________。
(4)![]() 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有______种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有______种。
(5)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 最合理的方案(不超过4步)。例如:
最合理的方案(不超过4步)。例如:
 ______________________________________________________________________________
______________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量 ( )
A. 大于57.3 kJ B. 等于57.3 kJ
C. 小于57.3 kJ D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组蛋白质中,可以在人体同一个细胞中产生的是( )
A. 胰高血糖素和胰蛋白酶 B. 抗体和干扰素
C. 溶菌酶和甲状腺激素受体 D. 生长激素和抗利尿激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下:

已知①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_____________。
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为__________________ ;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为_______________ (标准状况)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______(填选项序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。
已知K sp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c(Ca2+)=________________。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K1 =1.8×10-5mol·L-1H2SO4的电离平衡常数K2=1.2×10-2mol·L-1,K3 =1.3×10-8mol·L-1。在通入废气的过程中:
当恰好形成正盐时,溶液中离子浓度的大小关系为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com