
一定温度下向某容积固定的密闭容器中加入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)3C(g)+D(s) ΔH=-Q kJ·mol-1(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质A的转化率为α。请回答下列问题:
(1)Q1________Q(填“<”、“>”或“=”),由是__________________________________________________________
__________________________________________________________。
(2)A的转化率α=________(用含Q、Q1的代数式表示);平衡后,若加入少量物质D,A的转化率________(填“增大”、“减小”或“不变”)。
(3)反应达到平衡后,若升高温度,K________(填“增大”、“减小”或“不变”),混合气体的平均相对分子质量________(填“增大”、“减小”或“不变”)。
(4)维持温度和其他条件不变,若起始时向容器中加入的物质如下列四个选项,则反应达到平衡后放出的热量仍为Q1 kJ的是(稀有气体不参与反应)________(填序号)。
A.2 mol A、1 mol B、1 mol Ar
B.3 mol C、1 mol D
C.1 mol A、0.5 mol B、1.5 mol C、0.5 mol D
D.2 mol A、1 mol B、1 mol D
解析 本题综合考查了反应热、转化率、化学平衡移动等之间的关系,虽然综合性强,但每一问难度并不是很大,运用解化学平衡类试题的基本技巧即可顺利求解。因是可逆反应,2 mol A和1 mol B不可能完全反应,故Q1<Q,此时A的转化率α=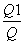 ×100%;平衡后,若加入少量物质D,由于D是固体,浓度不变,故A的转化率不变。因为是放热反应,升高温度,平衡逆向移动,K减小;升高温度时气体的质量增大,气体物质的量不变,故混合气体的平均相对分子质量增大。选项A、B、C、D所达到的平衡状态与原平衡均等效,但只有A、D选项达到平衡时放出的热量与原平衡放出的热量相等。
×100%;平衡后,若加入少量物质D,由于D是固体,浓度不变,故A的转化率不变。因为是放热反应,升高温度,平衡逆向移动,K减小;升高温度时气体的质量增大,气体物质的量不变,故混合气体的平均相对分子质量增大。选项A、B、C、D所达到的平衡状态与原平衡均等效,但只有A、D选项达到平衡时放出的热量与原平衡放出的热量相等。
答案 (1)< Q表示2 mol A和1 mol B完全反应时放出的热量,而该反应是可逆反应,2 mol A和1 mol B不可能完全反应
(2)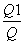 ×100% 不变 (3)减小 增大 (4)AD
×100% 不变 (3)减小 增大 (4)AD


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
根据表中短周期元素性质的数据判断,下列说法正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10 m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
A.①⑧形成的化合物具有两性
B.⑦位于第二周期第ⅥA族
C.④⑤形成的化合物是离子化合物
D.③的最高价氧化物对应的水化物碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:NaHCO3在水溶液中水解的热化学方程式为:NaHCO3(aq)+H2O(l)===H2CO3(aq)+NaOH(aq) ΔH=a kJ·mol-1;稀盐酸和稀NaOH的中和热为b kJ·mol-1。则等物质的量的NaHCO3(aq)与稀HCl(aq)反应的ΔH等于
( )
A.(a+b) kJ·mol-1 B.(a-b) kJ·mol-1
C.-(a-b) kJ·mol-1 D.-(a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/ (mol·L-1) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
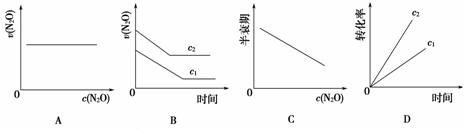
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种.已知:
(1)a、c均能与稀硫酸反应放出气体;
(2)b与d的硝酸盐反应,置换出单质d;
(3)c与强碱反应放出气体;
(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
|
| A. | Fe Cu Al Ag Mg |
|
| B. | Al Cu Mg Ag Fe |
|
| C. | Mg Cu Al Ag Fe |
|
| D. | Mg Ag Al Cu Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组利用Mn02和浓HCl及如图所示装置制备Cl2.下列分析中不正确的是( )
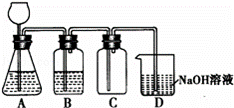
|
| A. | A中可用分液漏斗代替长颈漏斗 |
|
| B. | A中缺少加热装置 |
|
| C. | B中盛放的NaOH溶液可以净化Cl2 |
|
| D. | D中的导管口若连接倒置漏斗可防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应:2H2S+O2=2H2O+S、4NaI+O2+2H2SO4=2Na2SO4+2I2+2H2O、Na2S+I2=2NaI+S,下列物质氧化性强弱的判断正确的是( )
|
| A. | O2>I2>S | B. | H2S>NaI>H2O | C. | S>I2>O2 | D. | H2O>NaI>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯、溴和溴苯的物理性质如下表所示
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm﹣3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
如图为苯和溴取代反应的改进实验装置.其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑.
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应.写出A中所发生反应的化学方程式(有机物写结构简式): .
(2)试管C中苯的作用是 ;反应开始后,观察D试管,看到的现象为
(3)在上述整套装置中,具有防倒吸作用的仪器有 (填字母).
(4)反应完毕后,将a瓶中的液体取出,经过 (填分离操作的名称)可获得获得粗溴苯.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com